در مقاله آموزش فصل اول علوم نهم مواد و نقش آنها در زندگی به آموزش فصل اول در یک مقاله جذاب و کامل همراه با کلی تصویر آموزشی نوین پرداختیم، در این مقاله نیر قصد داریم به آموزش فصل دوم علوم نهم رفتار اتمها با یکدیگر طی یک مقاله آموزشی جذاب با بهره گیری از کلام ساده و گیرا در کمترین زمان بپردازیم.
در فصل دوم علوم نهم با مباحث ذرّه های سازنده مواد-داد و ستد الکترون و پیوند یونی-یونها در بدن ما-ویژگیهای ترکیب یونی-اشتراک الکترونها و پیوند اشتراکی-اشتراک الکترونی گسترده تر آشنا خواهید شد. فصل دوم علوم نهم یکی از فصلهای مهم برای امتحانات و آزمونهای ورودی است و مباحث این فصل پیش نیاز درس شیمی متوسطه دوم است.
برای تقویت پایه باید با دقت به بررسی این آموزش بپردازید تا در سالهای آینده و امتحانات پیش رو دچار مشکل نشوید. برای یادگیری فصل رفتار اتمها با یکدیکر در علوم نهم نیز نیازی به نگرانی نیست چون من سالار احمدی در این مقاله هر آنچه که برای درک و یادگیری این فصل نیاز دارید را در اختیار شما همراهان گرامی سایت بخون قرار میدهم پس برای یادگیری این فصل تا آخر این مقاله در سایت بخون همراه من باشید.
فایل صوتی آموزش فصل دوم علوم نهم
دوستان و همراهی گرامی سایت بخون آموزش کامل فصل دوم علوم نهم را در فایل صوتی زیر نیز میتوانید به صورت کامل گوش کنید و صفر تا صد هر آنچه که برای درک این فصل نیازمدید را در این فایل صوتی بیابید. اگر مطالب درسی و مباحث فصل دوم را به صورت شنیداری بهتر درک میکنید، پیشنهاد میکنم شنونده این فایل صوتی باشید.
آموزش مبحث ذرّه های سازنده مواد علوم نهم
در دنیای پیرامون ما مواد گوناوگونی وجود دارند، بعضی از مواد به صورت ترکیب از چند اتم و بعضی دیگر به صورت عناصر خالص کاربرد دارند. ذرههای سازنده هر ماده تعیین کننده ویژگی آن است، اما آیا تا به حال به ذرات سازنده مواد فکر کرده اید؟
بسیاری از موارد کاربردی زندگی ما به صورت ترکیب شیمیایی هستند. آب، شکر، سدیم کلرید، آمونیاک، اتانول، ضد یخ، کات کبود و کلسیم اکسید(آهک) مثال هایی از ترکیبهای شیمیایی هستند.
آمونیاک به عنوان کود به گیاهان تزریق میشود،اتانول جهت ضد عفونی وسایل و در فعالیت های پزشکی استفاده میشود. ضدیخ جهت جلوگیری از گرم شدن بیش از حد آب رادیاتور و جلوگیری از یخ زدن آب درون ماشین کاربرد دارد. کات کبود در صنایع کشاورزی کاربرد دارد. آهک در پخت و پز-ساخت و ساز-صنایع آب کاربردی است.

ذرات سازنده این مواد یونها و مولکولها هستند. ذرات سازنده و تشکیل دهنده مواد متفاوت است از این جهت مواد دارای ویژگی های متفاوتی نیز می باشند به طور مثال: ظاهر نمک و شکر یکسان است اما نمک از یون و شکر از مولکولهای چند اتمی تشکیل شده است.
یون ها دارای ذراتی با بار مثبت و منفی هستند و با حرکت در محلول ها می توانند باعث ایجاد جریان الکتریکی شوند. به طور مثال اگر پرمنگنات را در آب حل کنیم ذرات پرمنگنات در سرتاسر محلول پراکنده میشوند و سبب رسانایی الکتریکی محلول میشود. عامل این رسانایی الکتریکی ذرات مثبت و منفی یون ها هستند که به صورت پراکنده در حال حرکتاند. مولکولها بار الکتریکی ندارند به همین دلیل محلول آب و شکر خاصییت رسانایی الکتریکی ندارد.
پرمنگنات یک اکسنده قوی می باشد که در صنعت کاربرد دارد و به افزایش طول عمر میوه ها پس از برداشت نیز کمک می کند.
آموزش داد و ستد الکترون و پیوند یونی فصل دوم علوم نهم
اتم هایی با ویژگی هایی متفاوت هنگامی که در مجاورت اتمی دیگر قرار میگیرند در صورت مهیا بودن شرایط برای واکنش، واکنش خواهند داد و منجر به تولید ترکیبات شیمیایی جدیدی با خواصی متفاوت از مواد سازنده خود میشوند.
فلز سدیم در مجاورت با گاز کلر در شرایط مناسب واکنش میدهد و ترکیب سدیم کلرید تشکیل میشود. در این واکنش گاز سمی کلر با فلز پر خطر سدیم واکنش میدهند و سبب ایجاد سدیم کلرید سفید (نمک) میشوند که دارای خواص بسیار متفاوتی به نسبت اتمهای سازنده خود است.

در تشکیل ترکیبات یونی بعضی از اتمها با گرفتن الکترون به آنیون با بار منفی و بعضی دیگر از اتمها با از دست دادن الکترون به کاتیون با بار الکتریکی مثبت تبدیل میشوند.
هنگامی که فلز و نافلز در مجاورت همدیگر قرار میگیرند فلزات الکترون از دست میدهند و به کاتیون تبدیل میشوند و نافلزات با جذب الکترون به آنیون تبدیل خواهند شد. در واقع اتمها تمایل دارند با دریافت و یا آزاد کردن الکترون در واکنشهای شیمیایی به تعداد ۸ الکترون در آخرین لایه الکترونی خود برسند. به این قاعده قاعده هشت تایی یا اکتت گفته میشود که در ان اتمها تمایل دارند به آرایش گاز های نجیب برسند.
دوستان عزیز میتوانی از بخش گام به گام علوم نهم به پاسخ تمامی تمرینات این فصل همراه با آخرین تغییرات کتاب درسی دسترسی داشته باشید.
آموزش مبحث یونها در بدن ما فصل رفتار اتمها با یکدیگر
در طی روز ما مقادیر متفاوتی از انواع ماده شیمیایی را مصرف میکنیم و از کاربرد و تاثیرات این ترکیبات شیمیایی بر بدنمان نا آگاه هستیم. به طور مثال ترکیب شیمیایی سدیم کلرید(نمک) یکی از رایج ترین ترکیباتی است که ما به طور پیوسته مصرف میکنیم. یون سدیم موجود در نمک یکی از مهم ترین یونهای موجود در بدن ما میباشد که وظایف مهمی را از جمله ایجاد جریان الکتریکی در مغز و اعصاب و ماهیچههای بدن به خصوص قلب بر عهده دارد و مقدار این کاتیون از دیگر کاتیونهای موجود در خون بیشتر است.
مصرف کم و یا بیش از حد سدیم کلرید(نمک) منجر به اختلال هایی در بدن میشود که در نهایت فعالیت یاخته های بدن را مختل میکند.
از سری یونهای ضروری و حیاتی بدن می توانیم به یون آهن با بار الکتریکی ۲ مثبت اشاره کنیم که در انتقال اکسیژن به سراسر بدن نقش حیاتی دارد و گلبولهای قرمز با بهره گیری از یون آهن میتوانند اکسیژن را حمل کنند و دی اکسید کربن را به شش برگردانند.
در فصل قبل با درشت مولکول هموگلوبین حاضر در گلبولهای قرمز آشنا شدید، بدن ما برای تولید هموگلوبین به یون آهن با بار ۲ مثبت نیاز دارد، ما میتوانیم با مصرف پروتیئنهای مختلف-گوشت-جگر-خرما-سویا آهن مورد نیاز بدن را تامین کنیم اما گاها در صورت وارد آمدن جراحت و از دست رفتن مقادیر بسیار از خون بدن دکتر قرصهای آهن را تجویز میکند.
آموزش ویژگیهای ترکیب یونی فصل دوم علوم نهم
ترکیب یونی ساختار بخش عظیمی از ترکیبات شیمیایی است و ترکیبات یونی از بهم پیوستن یونهای مثبت و منفی پدیدار میآیند. یونهای مثبت و منفی همدیگر را جذب میکنند و در نهایت ترکیبات یونی از نظر بار الکتریکی خنثی هستند. ترکیبات یونی شکننده میباشند و در اثر ضربه خرد میشوند.
در حالت جامد این مواد رسانای الکتریکی نیستند و به صورت محلول رسانای جریان الکتریکی میباشند، به طور مثال حل شدن نمک در آب سبب ایجاد خاصییت رسانایی الکتریکی در آب می شود.
آموزش مبحث اشتراک الکترونها و پیوند اشتراکی علوم نهم
آب های موجود در سطح زمین چه به صورت قطرات باران-دانههای برف-بلورهای یخ و بخار شامل شمار بسیار زیادی از مولکولهای آب هستند. این مولکولها از اتمهای اکسیژن و هیدروژن تشکیل شدهاند. آب مقطر دارای خاصییت رسانایی الکتریکی نمیباشد و اتمهای آن بار های مثبت و منفی باهم تبادل نکردهاند.
در این ساختار مولکولها به جای تبادل الکترون، با یکدیگر الکترون به اشتراک میگذارند و در عمل هیچ الکترونی کم و یا زیاد نمیشود بلکه بین اتم های حاضر در پیوند به اشتراک گذاشته خواهد شد.
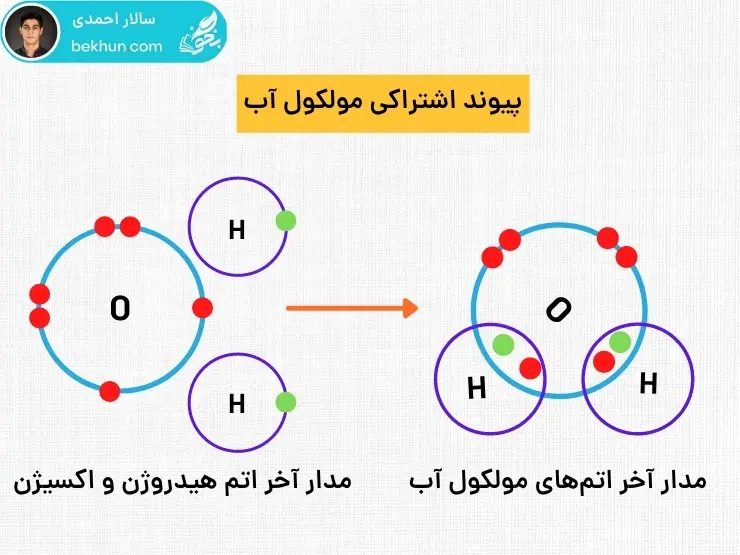
آموزش اشتراک الکترونی گستردهتر علوم نهم
در بعضی از پیوند های اشتراکی اتم حاضر در ترکیب با بیش از یک اشتراک به اتم های دیگر ترکیب خواهد شد و به جای دریافت یک پیوند اشتراکی دو یا چند پیوند اشتراکی دریافت خواهد کرد مانند اکسیژن-کربن-نیترروژن. هنگامی که ۲ نافلز در مجاورت همدیگر قرار میگیرند هر دو در پی دست یابی و رسیدن به قاعدهی هشت تایی یا اکتت هستند از این جهت در آخرین لایه از مدار الکترونی خود با یکدیگر الکترون به اشتراک میگذارند تا هر دو به قاعدهی اکتت برسند مانند کلر که با پیوند اشتراکی(پیوند کوالانسی) به قاعده اکتت میرسد. برای درک پیوند اشتراکی گستردهتر(پیوند کوالانسی) با دقت تصویر زیر را بررسی کنید.

پیوند اشتراکی بین اتمهای یک مولکول را به صورت خطی هم میتوانید نمایش دهید. هر پیوند اشتراکی یک خط محسوب میشود و برای مولکول اکسیژن که بین اتمهای آن ۲ پیوند اشتراکی وجود دارد ۲ خط لحاظ میشود.
همراهان گرامی سایت بخون امیدوارم که با مطالعه مقاله آموزش فصل دوم علوم نهم رفتار اتمها با یکدیگر مباحث پیوند اشتراک(پیوند کوالانسی) علوم نهم-خاصییت یونها و ویزگی های ترکیبات یونی به صورت کامل فرا گرفته باشید. در پایان پیشنهاد میکنم پس از بررسی آموزش فصل دوم علوم نهم و گام به گام این فصل سراغ نمونه سوالات علوم نهم بروید تا روند آموزشی خود را به بهترین شیوه به پایان برسانید.
در ضمن از طریق بخش آموزش علوم نهم، به صورت فصل به فصل میتوانید از آموزشهای رایگان ما هم بهرهمند شوید. منتظر نظرات گرانبهای شما دوستان نهمی عزیز و همراهان گرامی سایت بخون هستم.
سوالات متداول
- مبحث پیوند کوالاسی علوم نهم آموزش داده شده است؟
بله مبحث پیوند اشتراکی فصل دوم علوم نهم به صورت کامل آموزش داده شده است. - آموزش فصل دوم علوم نهم به چه صورت میباشد؟
آموزش فصل دوم علوم نهم به صورت مفهومی همراه با تصاویر آموزشی با بهره گیری از کلامی ساده و گیرا است. - آیا تمامی مباحث فصل دوم را آموزش دادهاید یا صرفا به مبحث پیوند اشتراکی علوم نهم پرداختهاید؟
تمامی مباحث فصل دوم علوم نهم بررسی شده است.






