در این مطلب از سایت بخون، تمام ریز مباحث فصل دوم شیمی دهم را استخراج خواهیم کرد و تمام نکات این فصل از شیمی دهم را ارائه داده و یک جزوه کامل و کافی را تحویل شما خواهیم داد. این فصل درباره هواکره به بحث میپردازد. در ادامه در مورد واکنش سوختن و واکنشهای شیمیایی و قانون پایستگی جرم توضیح میدهد. آخرین بخش این فصل نیز به مبحث موازنه کردن معادلههای شیمیایی میپردازد.
بخش موازنه کردن معادلههای شیمیایی از فصل دو شیمی دهم یکی از مهمترین مواردی است که هر دانش آموز سال دهمی در رشته تجربی و ریاضی باید آن را به خوبی فرابگیرد؛ چرا که در سالهای بعد نیاز پیدا خواهید کرد. اگر هنوز مطالعه آموزش فصل اول شیمی دهم را به اتمام نرساندهاید، پیشنهاد میشود از طریق لینک قرار داده شده، مطالعه کنید. همچنین اگر به سایر آموزشهای شیمی دهم نیاز داشتید، لینک آموزش شیمی دهم را دنبال نمایید.
تدریس فصل 2 شیمی دهم از صفحه 45 تا 48
در میان سیارههای سامانە خورشیدی، تنها زمین، اتمسفری دارد که امکان زندگی را روی آن فراهم میکند. این اتمسفر، مخلوطی از گازهای گوناگون است که تا فاصله ٥٠٠ کیلومتری از سطح زمین امتداد یافته است بهطوری که میتوان گفت ما در کف اقیانوسی از مولکولهای گازی زندگی میکنیم. جاذبە زمین این گازها را پیرامون خود نگه میدارد و مانع از خروج آنها از اتمسفر میشود.
از سوی دیگر، انرژی گرمایی مولکولها سبب میشود تا پیوسته آنها درحال جنبش باشند و در سرتاسر هواکره توزیع شوند. اغلب گازها نامرئی هستند؛ بهطوری که ما هوا را نمیتوانیم ببینیم. میان گازهای هوا، واکنشهای شیمیایی گوناگونی رخ میدهد که اغلب آنها برای ساکنان این سیاره سودمند هستند، اما برخی از این واکنشها مفید نبوده و فراوردههایی تولید میکنند که دلخواه و مطلوب ساکنان سیارە خاکی نیست.
هواکره دارای لایههای زیر است:
- تروپوسفر: این لایه نزدیکترین لایه به زمین است و حدود 12 کیلومتر با زمین فاصله دارد. تغییرات هوایی زمین، در این لایه رخ میدهد و با افزایش ارتفاع، دما و فشار هوا کاهش مییابد.
- استراتوسفر: تقریبأ 50 کیلومتر با زمین فاصله دارد و دارای گازهای O3 ,Co2, O2 ,N2 میباشد.
- مزوسفر: تقریبا 75 کیلومتر با زمین فاصله دارد.
- ترموسفر: تقریبا 500 کیلومتر با زمین فاصله دارد. به علت برخورد پرتوهای مغناطیسی با اتمها، اتمها میشکنند و به یون تبدیل میشوند. دارای گازهای O2 , N2 , O و یونهای مثبت، He , O , O2 , N2 , H میباشد.
تدریس شیمی دهم |هوا معجونی ارزشمند
امروزه در صنعت بستهبندی، میتوان زمان ماندگاری مواد غذایی را افزایش داد. جالب است بدانید در بستهبندی برخی مواد خوراكی از گاز نیتروژن استفاده میشود. افزون بر این، گاز نیتروژن کاربردهای دیگری نیز دارد. کاربردهایی نظیر، پر کردن تایر خودروها، انجماد مواد غذایی در صنعت سرماسازی و نگهداری نمونههای بیولوژیکی در پزشکی را دارد.
نیتروژن و اکسیژن و دیاکسید کربن از گازهای هواکره هستند که در لایه تروپوسفر قرار دارند و در زندگی روزانه نقش مهمی دارند. حدود 75 درصد از جرم هواکره، در نزدیکترین لایه به زمین (تروپوسفر) قرار دارد. این بخش از هوا كره، همان بخشی است كه ما در آن زندگی میكنیم. پس از تروپوسفر، هواکره رقیق و رقیقتر میشود. رطوبت هوا متغیر بوده و میانگین بخار آب در هوا، حدود یک درصد است. هر چند این مقدار از جایی به جای دیگر، از روزی به روز دیگر و حتی از ساعتی به ساعت دیگر تغییر میکند.
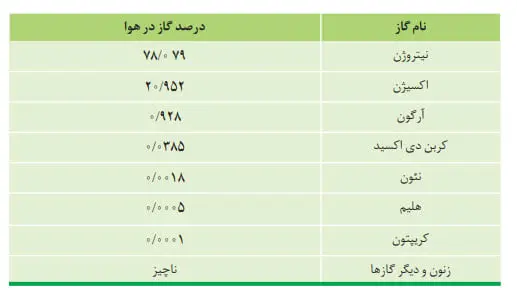
بخش عمدە هواكره را دو گاز نیتروژن و اكسیژن تشكیل میدهد. گاز آرگون در میان اجزای هواكره در رتبۀ سوم قرار دارد؛ بنابراین میتوان هوا را منبعی غنی برای تهیۀ این گازها دانست. در صنعت، این گازها را از تقطیر جزءبه جزء هوای مایع تهیه می كنند. برای مطالعه گام به گام فصل اول شیمی دهم، لینک قرار داده شده را دنبال کنید.
تدریس تقطیر جز به جز هوا مایع شیمی دهم
در این فرآیند، نخست هوا را از صافیهایی عبور میدهند تا گرد و غبار آن گرفته شود؛ سپس با استفاده از کاهش فشار، دما هوا را پیوسته كاهش میدهند. با كاهش دما هوا تا صفر درجه سلسیوس، رطوبت هوا به صورت یخ از آن جدا میشود. در دمای 78- درجه سلسیوس، گاز کربن دیاکسید هوا به حالت جامد در میآید و از مخلوط گازی جدا میشود.
اکسیژن در دما 183- و آرگون در دما 186- و نیتروزن در دما 196- به صورت مایع جدا میشوند. در دما 200-، محلول بسیار زیادی از چند مایع به دست میآید که به آن هوای مایع میگویند. در آخر با عبور هوای مایع از یك ستون تقطیر، گازهای سازنده جداسازی و در ظرفهای جدا ذخیره میشوند.
گاز آرگون
این گاز بیرنگ، بیبو، غیرسمی است. واکنشپذیری ناچیز دارد و به عنوان محیط بیاثر در جوشکاری، برش فلزها و در ساخت لامپهای رشتهای بهکار میرود.
گاز هلیم
هلیم بهعنوان سبکترین گاز نجیب، بیرنگ و بیبو است که کاربردهای فراوانی در زندگی دارد. از هلیم، افزون بر پرکردن بالنهای هواشناسی، تفریحی و تبلیغاتی در جوشکاری، کپسول غواصی و مهمتر از همه، برای خنک کردن قطعات الکترونیکی در دستگاههای تصویربرداری مانند MRI استفاده میشود. هلیم در کرە زمین به مقدار خیلی کم یافت میشود؛ به طوری که مقدار ناچیزی از آن در هوا و مقدار بیشتری در لایههای زیرین پوستە زمین وجود دارد؛ از این رو، منابع زمینی آن از هواکره سرشارتر و برای تولید هلیم در مقیاس صنعتی مناسبترند.
هلیم از واکنشهای هستهای در ژرفا زمین تولید میشود. این گاز پس از نفوذ به لایههای زمین، وارد میدانهای گازی میشود. یافتههای تجربی نشان میدهد که حدود 7 درصد حجمی از مخلوط گاز طبیعی را هلیم تشکیل میدهد. البته مقدار هلیم در میدانهای گازی گوناگون، متفاوت است. جداسازی هلیم از گاز طبیعی به دانش و فناوری پیشرفتهای نیاز دارد. متخصصان کشورمان تاکنون موفق به جداسازی و تهیە آن نشدهاند و همچنان، هلیم از دیگر کشورها وارد میشود.
شیمی دهم فصل دوم | مبحث اكسیژن، گازی واكنشپذیر در هواكره
اكسیژن یکی از مهمترین گازهای تشکیلدهندە هواکره است كه زندگی روی زمین به وجود آن گره خورده است. بهطوری که بسیاری از واکنشهای شیمیایی مانند فرسایش سنگ و صخره، زنگزدن، فساد مواد غذایی و… که پیوسته پیرامون ما رخ میدهند بهدلیل تمایل زیاد اکسیژن برای انجام واکنش است.
این عنصر در آب كره، در ساختار مولكولهای آب و در زیست کره در ساختار همۀ مولكولهای زیستی مانند كربوهیدراتها، چربیها و پروتئینها یافت میشود. در هواكره نیز این گاز بهطور عمده به شکل مولكولهای دو اتمی وجود دارد؛ هرچند مقدار این گاز در لایههای گوناگون هواكره با هم تفاوت دارد.
شیمی دهم فصل دوم | تركیب اكسیژن با فلزها و نافلزها
اكسیژن در سنگ کره به شکل اکسیدهای گوناگون نیز یافت میشود. برای نمونه فلز آلومینیم به شکل بوکسیت (Al2O3 به همراه ناخالصی) و سیلیسیم به شکل سیلیس (SiO2) در طبیعت وجود دارد. فلزها تنها یک نوع اکسید در طبیعت دارند، جالب است بدانید که افزون بر فلزهایی مانند طلا و پلاتین که به حالت آزاد در طبیعت یافت میشوند، فلزهایی نیز وجود دارند که با بیش از یک نوع اکسید در طبیعت شناخته شدهاند.
آهن نمونهای از آنهاست. این فلز در ترکیب با اکسیژن دو نوع اکسید با فرمولهای شیمیایی FeO ، Fe2O3 تولید میکند. به واکنش آرام مواد با اکسیژن که با تولید انرژی همراه است، واکنش اکسایش میگویند. به ترد شدن و خورد شدن فلزها در اثر اکسایش خوردگی گفته میشود.
آموزش فرمول نویسی ترکیبات یونی
یونهای تک تمی: یونهایی هستند که از یک اتم تشکیل شدهاند. برای نامگزاری کاتیونهای تک اتمی ابتدا کلمه یون و سپس نام فلز را مینویسیم. و برای نامگزاری آنیونهای تک اتمی، ابتدا کلمه یون وسپس نام فلز یا ریشه آن را مینویسیم و در آخر پسوند <<ید>> را اضافه میکنیم.
یون عنصرهای واسطه: در این دسته عناصری وجود دارند که بیش از یک نوع یون تولید میکنند. برای نوشتن نام آنها از اعداد رومی عددی استفاده میکنیم. عناصری نیز وجود دارند که یک نوع یون ایجاد میکنند که نیازی به اعداد رومی نیست. مثلا +Fe3 به صورت یون آهن (III) نوشته میشود.
| فارسی | 1 | 2 | 3 | 4 | 5 | 6 |
| عددی رومی | I | II | III | IV | V | VI |
| حروفی رومی | مونو | دی | تری | تترا | پنتا | هگزا |
یونهای چند اتمی: از ترکیب دو یا چند اتم تشکیل شدهاند که اتمها با پیوند کوالانسی به هم متصل میباشند. برای مطالعه نمونه سوال فصل اول شیمی دهم، لینک قرار داده شده را مطالعه نمایید. به مثال زیر توجه کنید.
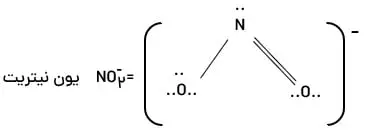
نکته: بار این یون به کل یونها مربوط است، به همین دلیل در بیرون کروشه قرار داده شده است.
ترکیبهای یونی: ابتدا یون کاتیون را در سمت چپ و یون آنیون را در سمت راست قرار میدهیم و سپس مقدار عددی هرکدام از بارها را به عنوان زیروند دیگری قرار میدهیم. در آخر اگر قابل ساده کردن باشند ساده میکنیم.
نکته: از نوشتن زیروند عددی یک خودداری میکنیم. 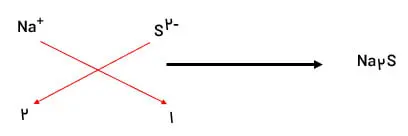
آموزش نامگزاری ترکیبهای یونی
آنیون تک اتمی: نام کاتیون+نام آنیون کافی است.

آنیون چند اتمی: نام کاتیون+نام آنیون. باید از اعداد رومی که داخل پرانتز قرار میگیرند، استفاده میکنیم.
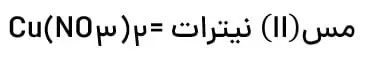
تدریس خط به خط فصل دو شیمی دهم |ساختار لوویس
برای رسم ابتدا تعداد الکترونهای لایه ظرفیت را به دست میآوریم و در ادامه اولین اتم از سمت چپ جدول تناوبی را به عنوان اتم مرکزی انتخاب نموده و بقیه اتمها را با استفاده از پیوند کوالانسی به اتم میانه متصل میکنیم. در ادامه تعداد الکترونهای پیوند کوالانسی را از تعداد کل الکترون بدست آمده کم میکنیم و از اتمهای طرفین شروع به تقسیم بندی میکنیم تا به اتم میانه میرسیم.

تدریس شیمی دهم | اکسیدها در فراوردههای سوختن
اكسیژن در سنگ کره به شکل اکسیدهای گوناگون نیز یافت میشود. برای نمونه فلز آلومینیم به شکل بوکسیت و سیلیسیم به شکل سیلیس در طبیعت وجود دارد شاید تصور کنید که فلزها تنها یک نوع اکسید در طبیعت دارند، جالب است بدانید که افزون بر فلزهایی مانند طلا و پلاتین که به حالت آزاد در طبیعت یافت میشوند، فلزهایی نیز وجود دارند که با بیش از یک نوع اکسید در طبیعت شناخته شدهاند.
آهن نمونهای از آنهاست. این فلز در ترکیب با اکسیژن دو نوع اکسید تولید میکند. در واقع 4 نوع سوختن داریم:
1- سوختن گاز شهری: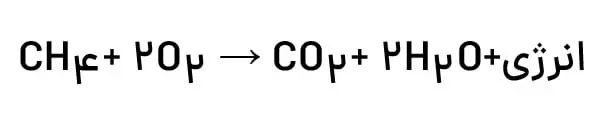 2- سوختن زغال سنگ:
2- سوختن زغال سنگ:

3- سوختن قندها و چربیها: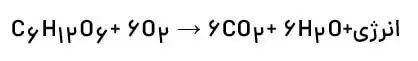
4- سوختن بنزین:
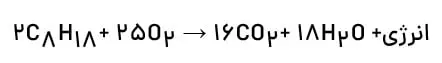
نوع فراوردهها در واكنش سوختن سوختهای فسیلی، به مقدار اكسیژن در دسترس بستگی دارد؛ بهطوری كه اگر اكسیژن كافی باشد، سوختن كامل انجام میشود و گاز كربن دیاكسید و بخار آب تولید میگردد. اما اگر مقدار اكسیژن كم باشد، گاز كربن مونوكسید به همراه دیگر فراوردهها تولید خواهد شد؛ در این حالت گفته میشود سوختن ناقص است.
برای مثال در سوختن سوختهای فسیلی رنگ زرد شعله، نشاندهندۀ سوختن ناقص است و رنگ آبی شعله، نشان میدهد كه وسیلۀ گازسوز به درستی كار میكند و اكسیژن كافی در محیط واكنش وجود دارد.
گاز کربن مونواکسید چگونه تشکیل میشود؟
گازی بیرنگ، بیبو و بسیار سمّی است. چگالی این گاز كمتر از هوا و قابلیت انتشار آن در محیط بسیار زیاد است؛ بهطوری كه به سرعت در همۀ فضای اتاق پخش میشود. از آنجا که میل تركیبی هموگلوبین خون با این گاز بسیار زیاد و بیش از 2۰۰ برابر اكسیژن است، مولكولهای آن پس از اتصال به هموگلوبین از رسیدن اكسیژن به بافتهای بدن جلوگیری میكنند. این ویژگی باعث مسمومیت میشود و سامانۀ عصبی را فلج میكند بهطوریکه قدرت هرگونه اقدامی را از فرد مسموم میگیرد و بدین ترتیب باعث مرگ میشود.
تدریس رفتار اکسیدهای فلزی و نافلزی شیمی دهم
اكسیدهای فلزی و نافلزی، به دلیل تنوع رفتار، كاربردهای فراوانی در زندگی دارند. برای نمونه برخی كشاورزان كلسیم اكسید (آهك) را به عنوان اكسیدفلزی برای افزایش بهرهوری در كشاورزی به خاك میافزایند؛ زیرا افزودن این نوع مواد به خاك سبب میشود تا مقدار و نوع مواد معدنی در دسترس گیاه تغییر كند. همچنین از كلسیم اكسید برای كنترل میزان اسیدی بودن آب دریاچهها استفاده میشود.
مرجانها، گروهی از كیسهتنان با اسكلت آهكی هستند. پژوهشها نشان میدهند كه این جانداران با افزایش مقدار كربن دیاكسید محلول در آب از بین میروند زیرا خاصیت اسیدی آب افزایش مییابد. بهطور کلی، اكسیدهای فلزی را اكسیدهای بازی و اكسیدهای نافلزی را اكسیدهای اسیدی مینامند؛ زیرا از واكنش اغلب آنها با آب به ترتیب باز و اسید تولید میشود.
نکته: کاغد PH که شناساگر اسید و بازها هستند، ترکیبات محلول در آب هستند که در محیطهای مختلف رنگ متفاوت دارند و در دمای اتاق گسترهای از صفر تا 14 را در بر میگیرد. در محیط اسیدی، قرمز رنگ و در محیط بازی، آبی رنگ و در محیط خنثی، سبز رنگ است. گستره PH اگر برابر 7 باشد، خنثی است و اگر بیشتر از 7 باشد، باز است و اگر کمتر از 7 باشد، اسید است.
(آنچه به بالا میرود، سرانجام باید پایین بیاید.) این اصطلاح بیان میكند؛ آلایندههایی كه از سوختن سوختهای فسیلی وارد هواكره میشوند و بالا میروند، سرانجام باید به زمین برگردند. این آلایندهها بهطور عمده شامل اکسیدهای اسیدی NO2 و SO2 هستند كه هنگام بارش در آب حل میشوند. بارشی كه خاصیت اسیدی چشمگیری دارد و به زمین فرو میریزد؛ در این حالت میگوییم باران اسیدی باریده است.
باران اسیدی آثار جبرانناپذیری بر جنگلها، باغهای میوه و زندگی آبزیان دارد؛ زیرا تغییر میزان خاصیت اسیدی آب به بافتهای جانداران آسیب میزند.
تدریس شیمی دهم | واکنشهای شیمیایی و قانون پایستگی جرم
در هر تغییر شیمیایی مانند: سوختن مواد، فاسد شدن موادغذایی و … از یک یا چند مادە شیمیایی، ماده (مواد) تازهای تولید میشود. هر تغییر شیمیایی میتواند شامل یك یا چند واکنش شیمیایی باشد كه هر یك از آنها را با یك معادله نشان میدهند. در این معادله، واكنشدهندهها در سمت چپ و فراوردهها در سمت راست نوشته میشوند. معادلههای شیمیایی به 2 حالت نوشته میشوند:
1- معادله نوشتاری: در این نوع معادله اطلاعاتی در مورد حالت فیزیکی مواد در اختیار نداریم.
2- معادله نمادی: معادلۀ نمادی، افزون بر نمایش فرمول شیمیایی واكنشدهندهها و فراوردهها میتواند حالت فیزیکی آنها و اطلاعاتی دربارۀ شرایط واكنش نیز ارائه کند؛ برای نمونه، معادلۀ شیمیایی بیان میكند كه این واكنش
در حضور كاتالیزگر پالتنی انجام میشود. در این معادلات، حالت جامد با استفاده از حرف (s) ، حالت مایع با استفاده از حرف (l) حالت گاز با استفاده از حرف (g) و حالت محلول آبی با استفاده از حرف (aq) نمایش داده میشود.
یكی از ویژگیهای مهم واكنشهای شیمیایی این است که همە آنها از قانون پایستگی جرم پیروی میكنند. یعنی تعداد اتمها باید در هر دو طرف واکنش باهم برابر باشند و جرم کل مواد در واکنش ثابت بماند یا همان موازنه شود.
موازنه كردن معادلە واكنشهای شیمیایی |فصل دو شیمی دهم
در واكنشهای شیمیایی، اتمی از بین نمیرود و بهوجود هم نمیآید، بلكه پس از انجام واكنش، اتمهای واكنشدهندهها به شیوههای دیگری به هم متصل میشوند و فراوردهها را بهوجود میآورند. این ویژگی نشان میدهد كه جرم مواد، پیش از واكنش برابر با جرم مواد، پس از واكنش است؛ به دیگر سخن، جرم مواد شركت كننده در یك واكنش شیمیایی، ثابت است.
مطابق قانون پایستگی جرم، شمار اتمهای هر عنصر در یك واكنش شیمیایی ثابت است. قبل از یادگیری موازنه این را بدانید که مثلا اگر 2 ملوکول آب داشته باشیم، ضریب 2 در تمام اندیشهای اتمها ضرب میشود. یعنی در ملوکول آب که H2O است، اندیس H برابر است با 2 و اندیس O برابر است با 1. و ضریب 2 یکبار در 2 و یکبار در 1 ضرب میشود. به معادله زیر توجه کنید:
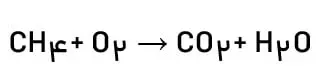
به ترکیبی که بیشترین اتم را دارد، ضریب یک میدهیم. با توجه به اتمهای این ترکیب ضرایبی را به مواد دیگر میافزاییم تا تعداد اتمها در هردو طرف واکنش برابر باشد. در موازنه نباید ظریب کسری به اتمها بدهیم. همچنین اندیس اتمها را به هیچ وجه تغیر نمیدهیم. به این روش، روش وارسی میگویند. در مثال بالا CH4 بیشترین تعداد اتم را دارد پس به آن ضریب یک میدهیم. کربن که در هر دو طرف واکنش برابر است.
هیدروژن در سمت چپ واکنش 4 اتم دارد ولی در سمت راست واکنش 2 اتم دارد. پس باید ضریب H2O را برابر 2 قرار دهیم تا باهم برابر شوند. در سمت راست واکنش در CO2 اندیس اکسیژن برابر 2 است پس 2 اتم داریم و از طرفی در H2O به اندازه 2 تا اتم اکسیژن داریم. چون ضریب ملوکول را در تک تک اتمها ضرب میکنیم. پس در سمت راست 4 اتم اکسیژن داریم ولی در سمت چپ 2 اتم. پس باید در سمت چپ برای اکسیژن ضریب 2 بزاریم تا با ضرایب اکسیژن در سمت راست برابر شود. نتیجه به صورت زیر است:
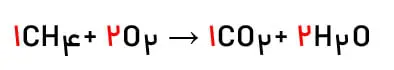
آموزش شیمی دهم فصل 2 |چه بر سر هواکره میآوریم؟
در سدە گذشته با تحول صنعتی، ماشینآلات سنگین طراحی و ساخته شد. صنایع بزرگ پدید آمدند و فراوردههای كشاورزی، دارویی، غذایی، نساجی، پتروشیمیایی و … به صورت انبوه و در مقیاس صنعتی تولید شدند. با این تحولات، نیاز به انرژی الكتریكی برای چرخاندن چرخهای اقتصادی، انرژی مورد نیاز حركت وسایل حمل ونقل و … به میزان چشمگیری افزایش یافت.
همە این فعالیتها سبب شد تا میزان مصرف بیحساب سوختهای فسیلی افزایش یابد و حجم انبوهی از كربندیاكسید وارد هواكره شود. سبك زندگی انسان، نوع وسایلی كه در زندگی استفاده میكند و رفتارهایی كه در شرایط مختلف محیطی انجام میدهد، روی هواكره تأثیر میگذارد؛ برای مثال، نوع وسیله نقلیهای كه برای رفتن به مدرسه، محل كار، سفر و … استفاده میكنیم، غذایی كه میخوریم، وسایل گرمایشی و حتی مدت زمانی كه موهای خود را با سشوار خشك میكنیم؛ بهدلیل مصرف انرژی الکتریکی، مقداری کربندیاکسید وارد هواکره میکند و درصدگازهای هواكره را تغییر میدهد.
در واقع سبك زندگی میتواند بیانگر میزان اثرگذاری هر یك از انسانها بر كرە زمین و هواكره باشد. ردپا اصطلاحی است كه به این اثر نسبت دادهاند. یكی از این ردپاها، ردپای كربندیاكسید است. برای این كه مقدار كربندیاكسید در هواكره از مقدار طبیعی آن فراتر نرود، باید مقدار اضافی کربندیاکسید بهوسیلە گیاهان یا دیگر پدیدههای طبیعی مصرف شود.
حال هر چه مقدار كربندیاكسید وارد شده به طبیعت زیادتر باشد، ردپای ایجاد شده سنگینتر و اثر آن ماندگارتر خواهد بود؛ زیرا زمان لازم برای تعدیل این اثر به وسیله پدیدههای طبیعی طولانیتر است.
تدریس شیمی دهم فصل دوم | مبحث اثر گلخانهای
گلخانهها، زمینهای کشاورزی ویژهای هستند که دور تا دور آنها را تا ارتفاع معینی با لایهای از پالستیکهای شفاف میپوشانند و در آنها گیاهان و میوههای گوناگونی پرورش میدهند. در گلخانهها در چهارفصل سال بهویژه در زمستان، فراوردههای کشاورزی مانند قارچ، خیار، گوجه فرنگی، توتفرنگی و… کشت میشود. نور خورشید هنگام گذر از هواكره با مولكولها و دیگر ذرههای آن برخورد میكند و تنها بخشی از آن به سطح زمین میرسد.
از اینرو، زمین گرم میشود و مانند یك جسم داغ از خود پرتوهای الكترومغناطیس گسیل میدارد؛ با این تفاوت كه انرژی پرتوهای گسیل شده، كمتر و طول موج آنها بلندتر است. کرۀ زمین با لایهای از گازها بهنام هواکره احاطه شده است. این لایه برای زمین همانند لایه پالستیکی برای گلخانه است و سبب گرم شدن کرۀ زمین میشود، بهطوری که اگر این لایه وجود نداشت میانگنین دمای کرۀ زمین به 18- درجه سلسیوس میرسید.
با این توصیف پرتوهای خورشیدی پس از برخورد به زمین دوباره با طول موجهای بلندتر به هواکره برمیگردند، اما برخی گازهای موجود در هواکره مانند CO2 ،H2O و… مانع از خروج آنها میشوند و بدینترتیب زمین را گرمتر میکنند. هرچه مقدار این گازها در هواکره بیشتر باشد، دمای زمین بالاتر خواهد رفت.
شیمی دهم فصل دوم |شیمی سبز، راهی برای محافظت از هوا كره
شیمی سبز شاخهای از شیمی است كه در آن شیمیدانها در جستجوی فرایندها و فراوردههایی هستند كه به كمك آنها بتوان كیفیت زندگی را با بهرهگیری از منابع طبیعی افزایش داد و همزمان از طبیعت محافظت کرد. در این راستا بایستی تولید و مصرف مواد شیمیایی را كه ردپاهای سنگینی روی كرۀ زمین برجای میگذارند، كاهش داد یا متوقف كرد. به 4 طریق این کار انجام میشود:
1- سوخت سبز: سوخت سبز، سوختی است كه در ساختار خود افزون بر كربن و هیدروژن، اكسیژن نیز دارد و از پسماندهای گیاهی مانند شاخ و برگ گیاه سویا، نیشكر و دانههای روغنی بهدست میآید. این مواد زیست تخریبپذیرند،
ازاین رو بهوسیلە جانداران ذرهبینی به مواد سادهتر تجزیه میشوند. اتانول و روغنهای گیاهی نمونههایی از این نوع سوختها هستند.
2- تبدیل CO2 به مواد معدنی: برای این منظور کربندیاکسید تولید شده در نیروگاهها و مراکز صنعتی را با منیزیم اكسید یا كلسیم اكسید واكنش میدهند.
3- تولید پلاستیکهای سبز: پلاستیكهای سبز، پلیمرهایی هستند كه بر پایۀ مواد گیاهی مانند نشاسته ساخته میشوند و به همین دلیل در ساختار آنها اكسیژن نیز وجود دارد. این پلاستیك در مدت زمان نسبتاً كوتاهی تجزیه میشوند و به طبیعت باز میگردند.
4- دفن کردن کربن دیاکسید: کربندیاکسید را میتوان به جای رها كردن در هواكره در مكانهای عمیق و امن در زیر زمین ذخیره و نگهداری كرد. سنگهای متخلخل در زیر زمین، میدانهای قدمیی گاز و چاههای قدیمی نفت كه خالی از این مواد هستند، جاهای مناسبی برای دفن این گاز هستند.
اوزون، دگر شكلی از اكسیژن در هواكره
عنصر اكسیژن به شكل دیگری نیز در هواكره یافت میشود كه به اوزون شهرت دارد. اوزون، گازی با مولكولهای سه اتمی در لایههای بالایی هواكره (استراتوسفر) مانند پوششی كرە زمین را احاطه كرده، هر چند که مقدار آن در هواكره ناچیز است. محافظت اوزون از زمین به گونهای است که در مولكول اوزون سه پیوند اشتراکی وجود دارد. هنگامی كه تابش پرانرژی فرابنفش به این مولكول میرسد، پیوند اشتراکی بین دوتا از اتمهای اكسیژن میشكند و مولكول اوزون به یك اتم اكسیژن و یك مولكول اكسیژن تبدیل میشود.
ذرههای تولید شده میتوانند دوباره در واكنش با یكدیگر، مولكول اوزون را تولید كنند اما در این واكنش، مقداری انرژی بهشکل تابش فروسرخ آزاد میشود. در باتریهای قابل شارژ، واكنشهای شیمیایی برگشتپذیر رخ میدهد. با تكرار پیوستۀ این دو واكنش، لایه اوزون بخش قابل توجهی از تابش فرابنفش را جذب میکند و تابشهای كم انرژی تر فروسرخ را به زمین گسیل میدارد.
اوزون در لایه تروپوسفر نیز یافت میشود. از آنجا كه اوزون از اكسیژن واكنش پذیرتر است، این ماده، آلایندههای سمی و خطرناك بهشمار میآید؛ بهطوری كه وجود آن در هوایی كه تنفس میكنیم، سبب سوزش چشمان و آسیب دیدن ریهها میشود. به دیگر سخن در تروپوسفر با نقش زیانبار و مضر اوزون مواجه هستیم در حالی كه در استراتوسفر، نقش مفید و محافظتی اوزون آشكار است.
گاز نیتروژن به عنوان اصلیترین جزء سازندۀ هواكره، واكنشپذیری بسیار كمی دارد و بهطور معمول با اكسیژن واكنش نمیدهد. تنها هنگام رعد و برق این دو گاز در هوا تركیب شده و به اكسیدهای نیتروژن تبدیل میشوند.
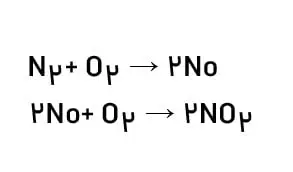
اوزون تروپوسفری: در هوای آلودۀ شهرهای صنعتی و بزرگ، به مقدار قابل توجهی اكسیدهای نیتروژن وجود دارد. در واقع این گازها از واكنش گازهای نیتروژن و اكسیژن درون موتور خودرو در دمای بالا بهوجود میآیند. از آنجا كه گاز نیتروژن دیاكسید به رنگ قهوهای است، هوای آلوده کلانشهرها اغلب به رنگ قهوهای روشن دیده میشود. در این هوای آلوده و در حضور نور خورشید، واکنش زیر رخ میدهد و مقداری گاز اوزون تولید میگردد. این اوزون، همان اوزون تروپوسفری است.

شیمی دهم فصل دوم |رفتار گازها
پخش شدن بوی نان تازه، گلاب و دود اسپند در فضای خانه، نشان میدهد كه مولكولهای یك مادۀ گازی در هوا منتشر شده و به یاختههای بویایی ما رسیده است. ماده به حالت گاز شكل و حجم معینی ندارد، بلكه به شكل ظرف محتوی آن درمیآید و همۀ فضای ظرف را اشغال میكند. از اینرو، حجم یك نمونه گاز با حجم ظرف محتوی آن برابر است.

گاز برخالف جامد و مایع تراكمپذیر است. بهطوری كه اگر به یك نمونه گاز درون سرنگ یا سیلندری با پیستون روان، فشار وارد كنیم، گاز فشردهتر و حجم آن كمتر میشود. قانون بویل یعنی اگر دما ثابت باشد، حجم گاز با فشار وارد بر آن رابطه عکس دارد یعنی هرچه فشار بیشتر باشد حجم کمتر است. فرمول قانون بویل به صورت زیر است:
P1.V1=P2.V2
نکته: این را به یاد داشته باشید نوع یکا برای فشار مهم نیست فقط همه باید هم یکا باشند.
قانون شارل یعنی اگر فشار ثابت باشد، حجم گاز با دمای آن نسبت مستقیم دارد یعنی اگر دما افزایش یابد، حجم گاز نیز افزایش مییابد.
V1/T1=V2/T2
نکته مهم: در این فرمول یکا دما حتما باید کلوین باشد.
دریافتید كه حجم یک نمونه گاز به مقدار، دما و فشار آن وابسته است. بنابراین، با تغییر هر یک از این كمیتها، حجم گاز تغییر میكند. برای یافتن رابطه بین حجم و مقدار یك نمونه گاز باید دما و فشار ثابت باشد. براساس قرارداد، شیمیدانها دمای صفر درجۀ سلسیوس فشار یک اتمسفر را به عنوان شرایط استاندارد (STP) در نظر گرفتهاند. در دمای صفر درجه سلسیوس و فشار یک اتمسفر، یک مول از گازها حجم یکسان که برابر 22/4 لیتر است را دارند.
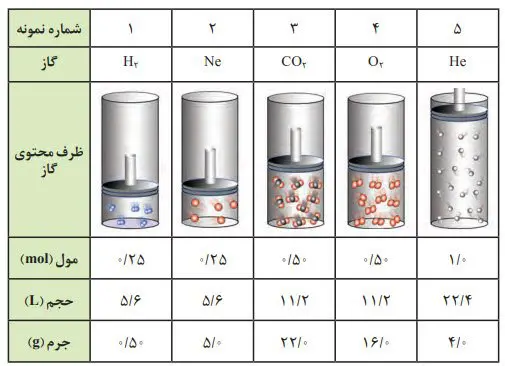
مطابق دادههای جدول در این شرایط با افزایش شمار مولهای هر گاز، حجم آن افزایش مییابد. از اینرو حجم یک نمونه گاز با شمار مولهای آن رابطهای مستقیم دارد. طبق این رابطه حجم یك مول گاز در STP برابر با 4/22 لیتر است؛ به دیگر سخن، حجم مولی گازها در STP برابر با 4/22 لیتر است.
تدریس شیمی دهم فصل دو | از هر گاز چقدر؟
به بخشی از دانش شیمی كه به ارتباط كمّی میان مواد شركت كننده در هر واكنش میپردازد، استوكیومتری واكنش میگویند. دانشی كه كمك میكند تا شیمیدانها و مهندسان در آزمایشگاه و صنعت با بهرهگیری از آن، مشخص كنند كه برای تولید مقدار معینی از یك فراورده به چه مقدار از هر واكنشدهنده نیاز است. به هر یک از ضرایب مواد داخل واکنش موازنه شده، ضریب استوکیومتری میگویند. به عکس زیر توجه کنید و سعی کنید به خاطر بسپارید.
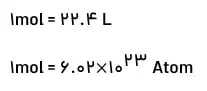
به مثال فوق توجه کنید تا این موضوع را به خوبی درک کنید. مثال: در واکنش سوختن پروپان، اگر شرایط STP فرض شود:
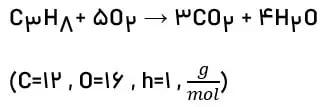
آ) برای تولید 5/6 لیتر Co2، چند گرم پروپان باید با اکسیژن بسوزد؟
ب) 5مول اکسیژن برابر چه تعداد اتم اکسیژن است؟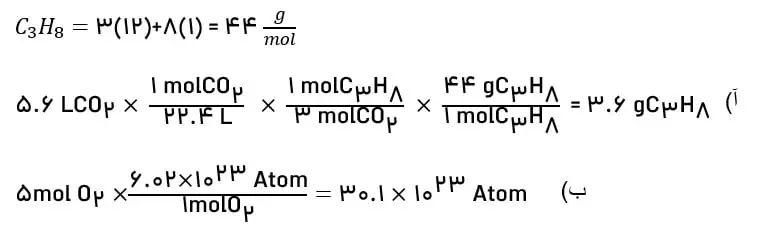
تولید آمونیاك، كاربردی از واكنش گازها در صنعت فصل دو شیمی دهم
گاز نیتروژن فراوانترین جزء سازندۀ هواكره بوده که در مقایسه با اكسیژن از نظر شیمیایی غیرفعال و واكنشناپذیر است؛ برای نمونه مخلوطی از گازهای اكسیژن و هیدروژن در حضور كاتالیزگر یا جرقه در یك واكنش سریع و شدید، منفجر میشود و آب تولید میكند. اما در مخلوطی از گازهای نیتروژن و هیدروژن حتی در حضور كاتالیزگر یا جرقه، هیچ واكنشی رخ نمیدهد. از اینرو گاز نیتروژن به جو بیاثر شهرت یافته و در محیطهایی كه گاز اكسیژن، عامل ایجاد تغییر شیمیایی است بهجای آن از گاز نیتروژن استفاده میکنند.
هر چند گاز نیتروژن واكنشپذیری ناچیزی دارد، اما امروزه در صنعت، مواد گوناگونی از آن تهیه میكنند كه آمونیاك یكی از مهمترین آنهاست. اكنون این پرسش مطرح است كه از نیتروژن با واكنشپذیری ناچیز، چگونه شیمیدانها آمونیاک و تركیبهای دیگر را تهیه میكنند. هابر واكنش میان گازهای هیدروژن و نیتروژن را بارها در دماها و فشارهای گوناگون انجام داد تا بتواند شرایط بهینه آن را پیدا كند.
سرانجام دریافت که اگر مخلوط این گازها از روی یك ورقۀ آهنی (کاتالیزگر) در دما و فشار مناسب عبور داده شود، با انجام واكنش، مقدار قابل توجهی آمونیاک تولید میشود؛ اما همۀ واكنشدهندهها به فراورده تبدیل نخواهد شد؛ زیرا این واكنش برگشتپذیر است؛ با این توصیف در ظرف واكنش مخلوطی از سه گاز هیدروژن، نیتروژن و آمونیاك وجود دارد. اكنون هابر با مشكل دیگری روبهرو بود:
چگونه میتوان فراوردۀ واكنش (آمونیاك) را از مخلوط واكنش جدا کرد؟ او با بررسی نقطۀ جوش این مواد، راهحلی را برای جداسازی آمونیاك پیدا کرد. طرح زیر، راهحل هابر را نشان میدهد:
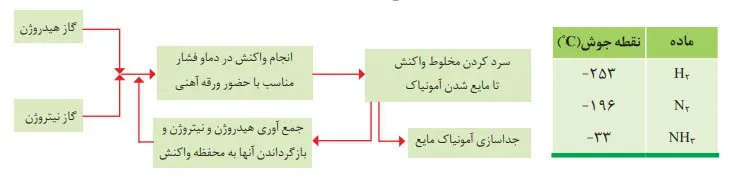
سخن آخر
خب دوستان خوب و عزیز پایه دهم و معلمان پرتلاش به پایان بحث آموزش فصل دوم شیمی دهم رسیدیم و تمامی سعی من این بوده که بتوانم با سادهترین زبان و کوتاهترین زمان ممکن، مباحث این فصل را در اختیار شما عزیزان قرار دهم؛ امیدوارم نهایت استفاده را برده باشید. برای مطالعه سایر فصول شیمی دهم به لینک قرار داده شده مراجعه کنید. همچنین برای مشاهده سایر مطالب مربوط به دروس پایه دهم لینک قرار داده شده را دنبال کنید.
برای اطلاع از بروزترین و داغترین مطالب و مقالات آموزشی ما، حتمأ در قسمت خبرنامه سایت بخون ثبت نام کنید و برای ایجاد دلگرمی و قوت قلب ما از قسمت ارسال دیدگاهها و نظرات، سوالات، نظرات و پیشنهادات خود را بنویسید و برای افزایش کیفیت کار ما، انتقادات خود را نیز بیان کنید.
راستی ما در سایت بخون یک بانک از نمونه سوالات استاندارد برای شیمی هم تدوین کرده و بهصورت رایگان در اختیارتان قرار دادهایم، برای دسترسی میتوانید از لینکهای زیر استفاده کنید:
سوالات متداول
- در این مقاله چه مباحثی آموزش داده شده است؟
تمام مباحث مربوط به فصل دوم شیمی دهم تجربی به صورت کامل تدریس شده است. - این مقاله دارای تصویر است؟
در این مقاله تصاویر همراه با توضیحات آمده است که یادگیری را راحتتر میکند. - با خواندن این مطلب میتوان فصل دوم شیمی دهم را به طور کلی آموخت؟
بله، همچنین با خواندن این مطلب و یادگیری آن در امتحان 20 بگیرید.