در این مطلب تمام ریز مباحث فصل اول شیمی دهم را استخراج میکنیم و تمام نکات این فصل از شیمی دهم را ارائه میدهیم و یک جزوه کامل و کافی را تحویل شما میدهیم. در مطلب بعدی که در سایت بخون قرار داده میشود، نمونه سوال فصل اول شیمی دهم را مورد بررسی قرار میدهد. این فصل از تشکیل عناصر شروع میشود و در مورد مفهوم مهم مول صحبت میکند و کار را تا آرایش الکترونی اتم و پیوند کوالانسی به پیش میبرد.
فصل اول شیمی دهم علاوه بر بودجه بندی قابل توجه در درس شیمی کنکور، از لحاظ ارتباط با سایر فصلها هم از اهمیت ویژهای برخوردار است. به همین خاطر امروز در سایت بخون به سادهترین زبان ممکن تدریس کامل فصل اول شیمی دهم را در اختیار شما عزیزان قرار خواهیم داد. در پایان این مقاله از شما انتظار میرود که تمام موضوعات و دروس این فصل را به خوبی فهمیده باشید به طوری که هیچ تست و سوالی نماند که به دست شما حل نشود.
همچنین برای مطالعه گام به گام فصل اول شیمی دهم، به لینک قرار داده شده مراجعه کنید. اما شیمی دهم به شش درس یا قسمت تقسیم میشود که تک به تک درسها را در ادامه توضیح خواهم داد.
- بخش اول: چگونگی تشکیل عنصرها
- بخش دوم: عنصرها و ایزوتوپها
- بخش سوم: طبقه بندی عنصرها
- بخش چهارم: نور و شناسایی عنصرها
- بخش پنجم: آرایش الکترونی
- بخش ششم: عناصر و پیوند شیمیایی
اگر هنوز به سایر مطالب مربوط به آموزش شیمی دهم را مطالعه نکردهاید، لینک فوق را دنبال کنید. در ادامه به تمام نکات مربوط به این درسها پی میبریم. به طوریکه سوالات تستی مربوط به فصل یک شیمی دهم مانند آب خوردن حل میکنید و برای امتحانات و کنکور نگران این فصل نمیشوید. برای آشنایی با تستهای شیمی کنکور به آدرس تست شیمی دهم مراجعه کنید.
تدریس شیمی دهم صفحه 2
همانطور که در بالا توضیح دادم، این درس مربوط به چگونگی تشکیل عناصر است. تلاش دانشمندان برای شناخت کیهان همچنان ادامه داشته است و در همین راستا دو فضاپیمای وویجر یک و دو در سال 1977 میلادی برای شناخت بیشتر سامانه خورشیدی، سفر خود را آغاز کردند. ماموریت آنها تهیه و ارسال شناسنامه فیزیکی و شیمیایی سیارههای مشتری، زحل، اورانوس و نپتون بوده است. دانشمندان از این طریق توانستند اطلاعات مفیدی از روند پیدایش عنصرها به دست آورند. برخی سیارهها از جنس گاز و برخی دیگر از جنس سنگ هستند.

با مشاهده تصویر بالا متوجه میشوید که سیاره مشتری بیشتر از گازهای هیدروژن و هلیوم متراکم تشکیل شده و این در حالی است که در کره زمین، دو عنصر آهن و اکسیژن از فرآوانی بیشتری برخوردارند.
برخی از دانشمندان معتقداند که سرآغاز کیهان با انفجاری مهیب به نام مهبانگ همراه بوده است که طی آن، انرژی بسیار زیادی آزاد شده است. ابتدا ذرههای زیر اتمی مانند الکترون، پروتون و نوترون پدید آمده است و سپس عنصرهای هیدروژن و هلیم و ایزوتوپهای آنها طی واکنشهای هستهای به وجود آمدهاند.
با گذشت زمان و کاهش دما، گازهای هیدروژن و هلیم تولید شده، متراکم شد و مجموعههای گازی به نام سحابی ایجاد کردند که بعدها باعث پیدایش ستارهها و کهکشانها شدند. ستارهها متولد میشوند، رشد میکنند و بعد از گذشت میلیونها سال با یک انفجار بزرگ میمیرند و عنصرهای موجود در آنها در فضا پرکنده میشوند. در طی واکنشهای هستهای، عنصرهای سنگینتر مانند کربن، نیتروژن، طلا و آهن و غیره به وجود آمدند.
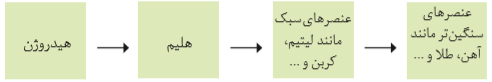
تاکنون 118 عنصر شناخته شده است که از این میان 92 عنصر در طبیعت یافت میشود و 26 عنصر ساخت دست بشر هستند.
محاسبه انرژی تولید شده در واکنشها
برای محاسبه انرژی تولید شده در این واکنشهای هستهای ستارهها، اینشتین رابطهای کشف کردکه با استفاده از آن به راحتی انرژی را محاسبه میکند.
E=mc2
در این رابطه، m جرم ماده بر حسب کیلوگرم و c همان سرعت نور که برابر با (108×3 متر بر ثانیه) و E انرژی آزاد شده را بر حسب ژول نشان میدهد. با استفاده از فرمول بالا به سوال زیر پاسخ دهید و پاسخ خود را با پاسخ زیر مقایسه کنید.
سوال: اگر در یک واکنش همجوشی هستهای مقدار 107×9 کیلوژول انرژی آزاد شده باشد، چند گرم ماده به انرژی تبدیل شده است؟
پاسخ:
E= 107×9 kj × 1000j = 1010×9 j , C = 108×3
1010×9 = m × (108×3)2
m = 10-6 kg
m = 10-3 g
تدریس صفحه 5 شیمی دهم | اتم و ویژگیهای آن
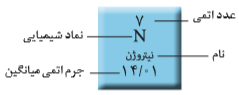
درس دوم از فصل اول شیمی سال دهم، شامل عنصرها و ایزوتوپها میشود. همانطور که در درس علوم آموختهاید، نماد شیمیایی یک عنصر، یک یا دو حرف از نام لاتین عنصر است که حرف اول بزرگ و حرف دوم کوچک نوشته میشود. مانند Al برای آلومینیم و H برای هیدروژن. در نوشتن نماد شیمیایی یک عنصر، عدد اتمی (Z) و عدد جرمی (A) در کنار نشانه آن، نوشته میشوند.
 عدد اتمی (Z) برابر با تعداد پروتونهای اتم و عدد جرمی (A) برابر با مجموع تعداد پروتونها و نوترونهای اتم است. یعنی:
عدد اتمی (Z) برابر با تعداد پروتونهای اتم و عدد جرمی (A) برابر با مجموع تعداد پروتونها و نوترونهای اتم است. یعنی:
Z=p , A=Z+N
سوال: عدد جرمی عنصر X برابر 85 و تعداد نوترونهای اتم آن، یک و نیم برابر تعداد الکترونهای آن است. عدد اتمی این عنصر چند است؟
پاسخ:
N=1.5Z
85=Z+1.5 Z
85=2.5 Z
Z=34
آیا همۀ اتم های یك عنصر پایدارند؟
شیمیدانها مادهای را عنصر مینامند كه از یك نوع اتم تشکیل شده باشد، برای نمونه منیزیم و هلیم عنصر به شمار میروند زیرا یك نمونه منیزیم حاوی اتم های منیزیم و یك نمونه هلیم حاوی اتم های هلیم است. جالب است بدانید بررسیها نشان میدهد كه اغلب در یك نمونۀ طبیعی از عنصری معین، اتمهای سازنده، جرم یکسانی ندارند. برای مثال بررسی یك نمونه منیزیم نشان میدهد كه جرم همۀ اتمهای منیزیم در این نمونه یکسان نیست، بلکه مخلوطی از سه هممکان (ایزوتوپ) است.
ایزوتوپها و رادیوایزوتوپها
ایزوتوپ های یك عنصر دارای Z یکسان، اما A متفاوت هستند. خواص شیمیایی اتمهای هر عنصر به عدد اتمی آن وابسته است؛ از این رو اتمهای منیزیم همگی خواص شیمیایی یکسانی دارند و در جدول دورهای عنصرها تنها یك مکان را اشغال میكنند؛ این در حالی است كه همین ایزوتوپها در خواص فیزیکی وابسته به جرم، مانند چگالی با یکدیگر تفاوت دارند.
رادیوایزوتوپها
رادیوایزوتوپها به آن دسته از عنصرهایی میگویند که خاصیت پرتوزایی دارند. همچنین عنصرهای ناپایداری هستند که بر اثر پرتوزایی از بین رفته و به عنصرهای سبکتر تبدیل میشوند. به پدیده خروج خود به خود پرتوهای نامرئی خطرناک از رادیوایزوتوپها، پرتوزایی گفته میشود. از رادیوایزوتوپها میتوان در پزشکی به عنوان رادیودارو و در نیروگاههای اتمی به عنوان سوخت هستهای استفاده کرد.
نیمعمر هر ایزوتوپ بهمعنای میزان پایداری آن ایزوتوپ در طبیعت است. نیمعمر به مدتزمانی که طول میکشد تا نصف جرم اولیه یک ایزوتوپ تجزیه شود، نیمعمر میگویند.
نکته: هرچه نیمعمر یک ایزوتوپ کمتر باشد، آن ایزوتوپ ناپایدارتر است.
تکنسیم، نخستین عنصر ساخت بشر
عنصر تکنسیم که در راکتور هستهای ساخته شده است، در تصویر برداری پزشکی اهمیت فوقالعادهای دارد و دارای عدد جرمی 99 و عدد اتمی 43 است. از آنجا که نیمعمر این عنصر شش ساعت است، نمیتوان مقادیر زیادی از این عنصر را تهیه و برای مدت طولانی نگهداری کرد. همچنین در تصویربرداری از غده تیروئید نیز استفاده میشود، زیرا غده تیروئید هنگام جذب یون یدید، یون حاوی تکنسیم را نیز جذب میکند و با افزایش این یون در غده، امکان عکسبرداری فراهم میشود.
اورانیم (U)
اورانیم شناختهشدهترین فلز پرتوزایی است كه یکی از ایزوتوپهای آن، اغلب به عنوان سوخت در راکتورهای اتمی بهکار میرود. دارای عدد جرمی235 و عدد اتمی 92 است، که به شکل اکسید اورانیم بودهاست. غنیسازی اورانیوم یکی از مراحل چرخه تولید سوخت هستهای است.
طبقه بندی عنصر ها
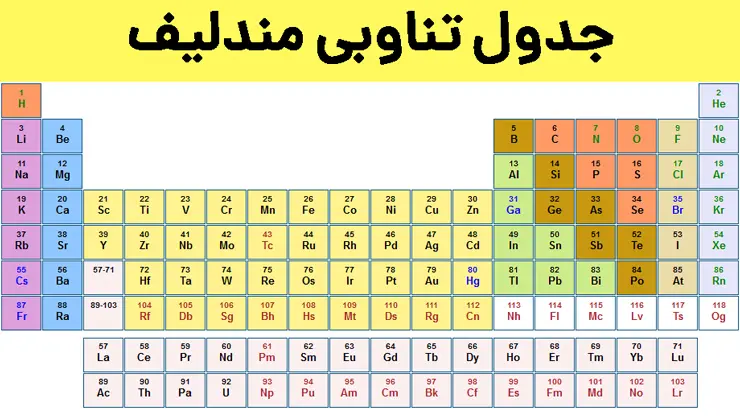
در جدول دورهای، عنصرها بر اساس افزایش عدد اتمی سازماندهی شدهاند، بهطوری که از عنصر هیدروژن با عدد اتمی یک، آغاز و به عنصر شماره 118 ختم میشود. این جدول هفت دوره و هجده گروه دارد. هر ردیف افقی که چیدمان عناصر بر حسب افزایش عدد اتمی است، دوره نام دارد؛ در حالی که هر ستون، شامل عنصرها با خواص شیمیایی مشابه است و گروه نام دارد. هر خانه از جدول به یک عنصر تعلق دارد که اطلاعات شیمیایی آن عنصر را نشان میدهد و هر عنصر با یک نماد شیمیایی، عدد اتمی و جرم اتمی میانگین مشخص میشود. برای نمونه خانه شماره هفت، به عنصر نیتروژن تعلق دارد.
دانشمندان برای اینكه بتوانند خواص فیزیكی و شیمیایی هر ماده را در محیطی مانند بدن انسان، محیط زیست، محیط آزمایش و… بررسی و اثر آن را گزارش كنند، باید بدانند كه چه جرمی از اتمها یا مولكولهای آن ماده وارد محیط شده است؛ از اینرو آنها همواره در پی یافتن سنجهای مناسب و در دسترس برای اندازهگیری جرم اتمها بودهاند.
اتمها بسیار ریزند بهطوری که نمیتوان آنها را بهطور مستقیم مشاهده و جرم آنها را اندازهگیری كرد؛ به همین دلیل دانشمندان مقیاس جرمنسبی را برای تعیین جرم اتمها به كار میبرند. مطابق این مقیاس، جرم اتمها را با وزنه ای می سنجند كه جرم آن یک دوازدهم جرم ایزوتوپ کربن دوازده است. به این وزنه یکای جرم اتمی یا amu میگویند.
با تعریف amu، شیمیدانها موفق شدند جرم اتمی دیگر عنصرها و همچنین جرم ذرههای زیراتمی را اندازهگیری کنند. در این مقیاس جرم پروتون و نوترون در حدود 1amu بوده در حالی که جرم الکترون ناچیز بوده و برابر یک دوهزارم amu، است.
جرم اتمی عنصرها شیمی دهم
هیدروژن در طبیعت دارای سه ایزوتوپ با عدد جرمی یک، دو، سه و عدد اتمی یک است که فراوانی و جرم اتمی متفاوتی دارند، اما در جدول دورهای یک خانه به این ایزوتوپها اختصاص یافته است. برای همین جرم اتمی موجود در جدول، جرم اتمی میانگین این سه ایزوتوپ است.
محاسبه جرم اتمی میانگین
اگر عنصری از ایزوتوپهایی با جرمهای اتمی m1,m2 و با فراوانیهای f1,f2 تشکیل شده باشد، برای محاسبه جرم اتمی میانگین از رابطه زیر استفاده میشود:
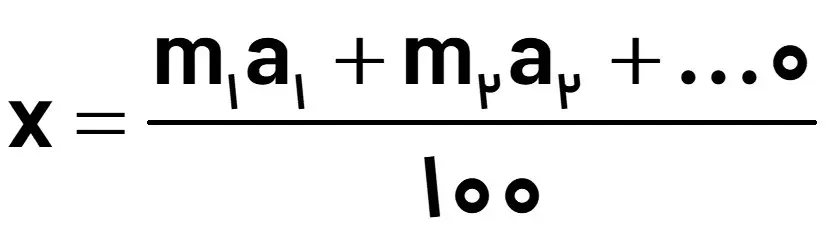
نکته: اگر فراوانیها بر حسب درصد بیان شود، مجموع فراوانیها در مخرج کسر، برابر با عدد 100 خواهد بود.
تدریس شمارش ذرهها از روی جرم آنها شیمی دهم
همانطور که میدانید اتمها بهطور باور نکردنی بسیار ریز هستند و نمیتوان با هیچ دستگاهی با شمارش تک تک آنها، تعداد اتم را به دست آورد. دانشمندان با استفاده از دستگاهی به نام طیف سنج جرمی، جرم اتمها را با دقت زیادی اندازه گرفتهاند. دانشمندان در گذشته در جستجوی رابطهای بودند که بین تعداد درهها و جرم اتمها ارتباطی مناسب برقرار کنند. آنها دنبال عددی بودند که بتوانند به کمک آن، تعدادی از اتمها را انتخاب کنند که جرم آنها بر حسب گرم از لحاظ عددی معادل جرم اتمی برحسب واحد amu باشد و آن عدد همان عدد آووگادرو بود.
نکته: به تعداد 6.02×1023 ذره از یک ماده، یک مول از آن ماده میگویند. به جرم یک مول ذره از هر ماده، جرم مولی آن ماده میگویند که یکای آن گرم بر مول است.
درسنامه مبحث نور کلید شناخت جهان شیمی دهم
به دلیل اینکه خورشید و دیگر اجرام آسمانی از ما بسیار دور هستند، ویژگیهای آنها را نمیتوان به طور مستقیم اندازهگیری كرد. همچنین دما اجسام بسیار داغ را نمیتوان با ابزاری مانند دماسنج تعیین كرد؛ زیرا دماسنج در این دماها ذوب میشود؛ با این توصیف چگونه میتوان دمای خورشید، اجزای سازندۀ آن و دما شعلههای بسیار داغ را تعیین كرد و اطلاعات ارزشمندی از آنها به دست آورد؟
نور، امکان یافتن پاسخ این پرسشها را فراهم می آورد. نوری كه از ستاره یا سیارهای به ما می رسد، نشان میدهد كه آن ستاره یا سیاره از چه ساخته شده و دمای آن چقدر است؟ دانشمندان با دستگاهی به نام طیف سنج، میتوانند از پرتو های گسیلشده از مواد گوناگون، اطلاعات ارزشمندی دربارۀ آنها به دست آورند.
نور خورشید، اگرچه سفید به نظر میرسد اما با عبور از قطرههای آب موجود در هوا، كه پس از بارش هنوز در هوا پراكنده است، تجزیه می شود و گسترهای پیوسته از رنگها را ایجاد میکند این گستره رنگی شامل بینهایت طول موج از رنگهای گوناگون است.
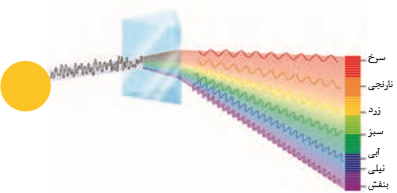
نور خورشید از دو بخش تشکیل میشود، یکی بخش مرئی و دیگری بخش نامرئی است. بخش مرئی محدودهای از پرتوهای خورشیدی که باچشم قابل دیدن است، که گسترهای از طول موجهای بین 400 تا 700 نانومتر را تشکیل میدهد. بخش نامرئی شامل دو قسمت است، قسمت اول پرتوهایی با طول موج کمتر از 400 نانومتر است که شامل پرتوهای فرابنفش، ایکس و گاما است. قسمت دوم پرتوهایی با طول موج بیشتر از 700 نانومتر است که شامل پرتوهای فروسرخ، ریزموجها و امواج رادیویی است.
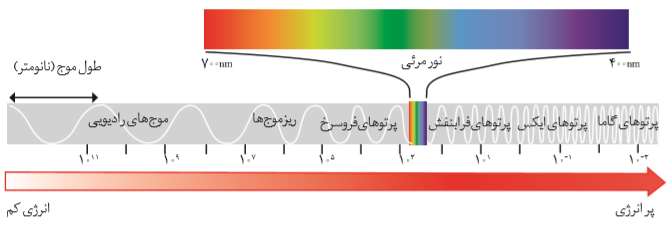
به فاصله بین دو برآمدگی کنار هم در یک موج، طول موج میگویند که هرچه کمتر باشد، انرژی موج بیشتر است. برای نمونه انرژی نور آبی از نور سرخ بیشتر است.
نور، نشر نور و طیف نشری خطی
به فرآیندی که در آن یک ترکیب شیمیایی با جذب انرژی از خود، پرتوهای الکترومغناطیسی گسیل میکند، نشرنور گفته میشود. اگر نور نشرشده از ترکیب یک عنصر را از یک منشور عبور دهیم، طیف نوری شامل چند خط جدا از هم، تشکیل میشود که به آن طیف نشری خطی میگویند.
تجربه نشان میدهد كه بسیاری از نمكها شعلۀ رنگی دارند، به طوری كه اگر مقداری از محلول نمك را با افشانه روی شعله بپاشیم، رنگ شعله تغییر میكند؛ برای نمونه رنگ شعلۀ فلز سدیم و تركیبهای گوناگون آن مشابه و زرد رنگ، درحالی كه رنگ شعلۀ فلز مس و تركیبهای گوناگون آن مشابه و سبزرنگ است. طیف نشری خطی لیتیم در پایین آمده است.
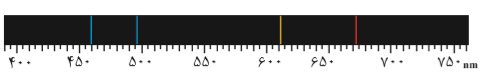
از آنجاكه طیف نشری خطی لیتیم در گسترۀ مرئی، تنها شامل چهار خط یا طول موج رنگی است به آن طیف خطی میگویند. بررسیها نشان می دهد كه هر عنصر، طیف نشری خطی ویژۀ خود را دارد و مانند اثر انگشت ما، میتوان از آن طیف برای شناسایی عنصر استفاده كرد.
ساختار اتم و رفتار آن شیمی دهم
اتم هیدروژن به عنوان سادهترین اتم، تنها دارای یك پروتون در هسته و یك الکترون پیرامون آن است. در گسترۀ مرئی طیف نشری خطی به دست آمده از اتمهای آن، وجود چهار خط یا نوار رنگی با طولموج و انرژی معین، تأیید شده است. از آنجاكه هر نوار رنگی در طیف نشری خطی، نوری با طول موج و انرژی معین را نشان می دهد، نیلز بور بر این باور بود كه از بررسی تعداد و جایگاه آنها، می توان اطلاعات ارزشمندی از ساختار اتم هیدروژن به دست آورد.
او پس از پژوهشهای بسیار، توانست مدلی برای اتم هیدروژن ارائه كند. اگرچه مدل بور با موفقیت توانست طیف نشری خطی هیدروژن را توجیه كند اما توانایی توجیه طیف نشری خطی دیگر عنصرها را نداشت.
در این مدل، اتم را كره ای درنظر می گیرند كه هسته در فضایی بسیار كوچك و در مركز آن جای دارد و الکترون ها در فضایی بسیار بزرگ تر و در لایههایی پیرامون هسته توزیع می شوند. این لایهها را از هسته، به سمت بیرون شماره گذاری می كنند و شمارۀ هر لایه را با n، نمایش میدهند. n را عدد کوانتومی اصلی مینامند. یعنی برای لایه اول، n برابر یک و برای لایه دوم، n برابر دو و غیره است. هر لایه اتمها میتواند تعدادی الکترون را در خود جای دهند که از رابطهی 2n2 به دست میآیند.
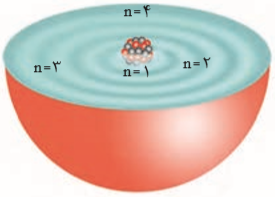
هر بخش پررنگ، مهمترین بخش از یك الکترونی را نشان میدهد. بخشی كه الکترونهای آن لایه، بیشتر وقت خود را در آن فاصله از هسته سپری میكنند به این معنا كه الکترون در هر لایهای كه باشد در همهی نقاط پیرامون هسته حضور مییابد اما در محدودهی یاد شده احتمال حضور بیشتری دارد.
الکترون ها در هر لایه، آرایش و انرژی معینی دارند و اتم از پایداری نسبی برخوردار است به طوری كه گفته می شود اتم در حالت پایه قرار دارد. طبق مدل بور، انرژی الکترون با فاصله آن از هسته، رابطه مستقیم دارد. هرچه الکترون از هسته دورتر میشود، انرژی آن افزایش مییابد. الکترونها در اتم نیز برای گرفتن یا از دست دادن انرژی هنگام انتقال بین لایهها با محدودیت مشابهی همانند بالا رفتن از پلکان روبهرو هستند؛ برای نمونه، هنگامی كه به اتمهای گازی یك عنصر با تابش نور یا گرم كردن، انرژی داده میشود، الکترونها با جذب انرژی معین از لایهای به لایۀ بالاتر انتقال مییابند. از سوی دیگر هر چه مقدار انرژی جذب شده بیشتر باشد، الکترونها به لایههای بالاتر انتقال مییابند.
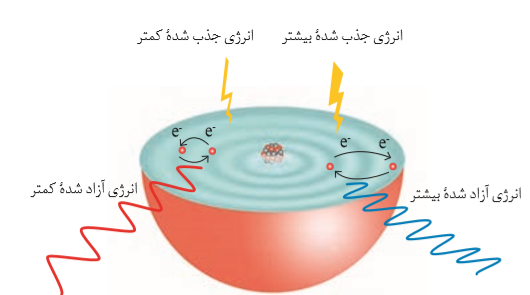
با این توصیف انرژی داد و ستد شده هنگام انتقال الکترونها در اتم، كوانتومی است و انرژی در پیمانههای معینی، جذب یا نشر میشود؛ به همین دلیل، چنین ساختاری را برای اتم، مدل کوانتومی اتم نامیدهاند. حال اگر به اتمها در حالت پایه انرژی داده شود، الکترونهای آنها با جذب انرژی به لایههای بالاتر انتقال می یابد. به اتمها در چنین حالتی، اتم های برانگیخته میگویند.
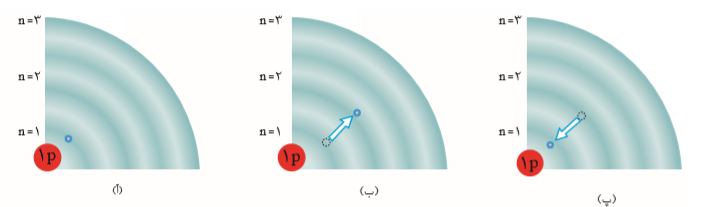
- آ) الکترون در حالت پایۀ اتم هیدروژن
- ب) الکترون در حالت برانگیخته از اتم هیدروژن
- پ) بازگشت الکترون به حالت پایه
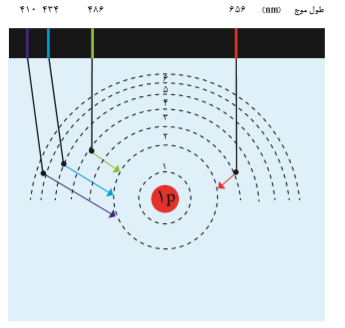
اتمهای برانگیخته پرانرژی و ناپایدارند؛ از این رو تمایل دارند دوباره با از دستدادن انرژی به حالت پایدارتر و در نهایت به حالت پایه برگردند. از آنجاكه برای الکترون، نشر نور، مناسبترین شیوه برای از دستدادن انرژی است، الکترونها در اتم برانگیخته، هنگام بازگشت به حالت پایه، نوری با طول موج معین نشر می كنند.
اینك میتوان گفت هر نوار رنگی در طیف نشری خطی هر عنصر، پرتوهای نشر شده هنگام بازگشت الکترونها را از لایههای بالاتر به لایههای پایینتر نشان میدهد. از آنجاكه انرژی لایههای الکترونی پیرامون هستۀ هر اتم ویژۀ همان اتم و به عدد اتمی آن وابسته است، انرژی لایهها و تفاوت انرژی میان آنها در اتم عنصرهای گوناگون، متفاوت است؛ بنابراین انتظار میرود هر عنصر، طیف نشری خطی منحصر به فردی ایجاد کند.
عدد کوانتومی اصلی و فرعی شیمی دهم
عنصرها در جدول دورهای برمبنای عدد اتمی یا تعداد الکترونهای اتم خود، چیده شدهاند. به طوری كه اتم هیدروژن با یك الکترون و اتم هلیم با دو الکترون به ترتیب اولین و دومین عنصر جدول است. این روند تا عنصر 118 جدول دورهای ادامه مییابد و اتم هر عنصر نسبت به اتم عنصر پیش از خود، یك الکترون بیشتر دارد. با استفاده از این فرمول 2n2 محاسبه میشود که هر لایه چند تعداد الکترون در خود جای میدهند. به میزان گنجایش الکترون در لایهها، زیرلایه میگویند.
زیرلایهها برای پذیرفتن الکترون محدودیت دارند و نمیتوانند بیش از تعداد معلوم، الکترون بگیرند. و تعداد پذیرش هر زیرلایه متفاوت است. زیرلایه اول دارای عدد کوانتومی فرعی صفر و نماد s است. زیرلایه دوم دارای عدد کوانتومی فرعی یک و نماد p است. زیرلایه سوم دارای عدد کوانتومی فرعی دو و نماد d است. زیرلایه چهارم دارای عدد کوانتومی فرعی سه و نماد f است. زیرلایه پنجم دارای عدد کوانتومی فرعی چهار و نماد g است. عدد کوانتومی فرعی را با علامت l نمایش میدهند. از فرمول 4l+2 حداکثر الکترونهای هر زیرلایه، محاسبه میشود.
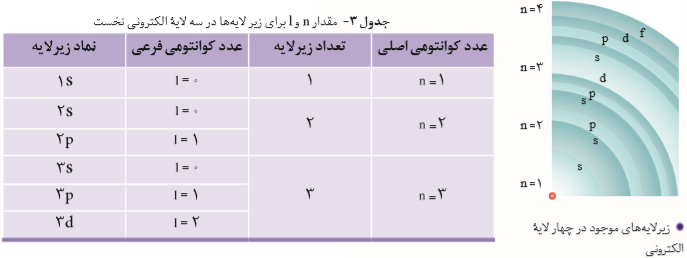
آرایش الکترونی اتم
رفتار و ویژگیهای هر اتم را میتوان از روی آرایش الکترونی آن توضیح داد؛ بنابراین یافتن آرایش درست الکترونها در هر اتم از اهمیت بسیاری برخوردار است. قاعدۀ آفبا ترتیب پرشدن زیرلایهها را در اتمهای گوناگون نشان میدهد. مطابق این قاعده، هنگام افزودن الکترون به زیرلایهها، نخست زیرلایههای نزدیكتر به هسته پر میشود، که دارای انرژی کمتری است و سپس زیرلایههای بالاتر، پر خواهد شد. هنگام پر شدن اتم از الکترون، نخست زیرلایه 1s و سپس زیرلایههای 2s و 2p از الکترون پر میشوند؛ با این توصیف باید در اتم عنصرهای دوره سوم زیرلایههای 3s,3p,3d پر شود.
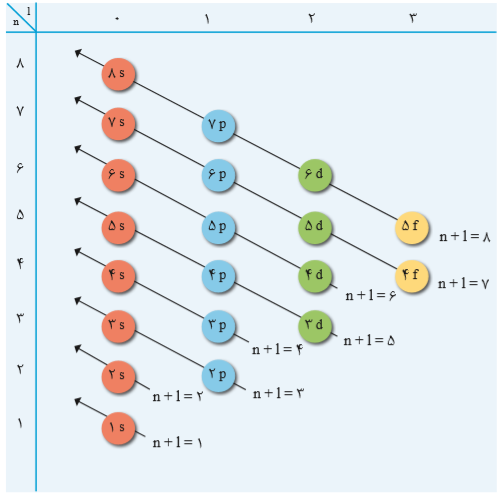
بر این اساس، آرایش الکترونی تعدادی از عناصر به شکل زیر خواهد بود.
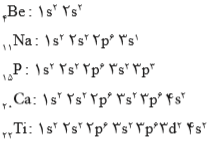
آرایش الکترونی فشرده
در این آرایش الکترونی از نماد گاز نجیب استفاده شده است. گازهای نجیب، در گروه 18 جدول دورهای عناصر واقع شدهاند. برای دستیابی به آرایش فشرده، نخست آرایش اتم موردنظر به صورت گسترده نوشته میشود؛ سپس بخشی از آرایش الکترونی، كه همانند آرایش الکترونی یك گاز نجیب است با عبارت [نماد شیمیایی گاز نجیب] جایگزین میشود.
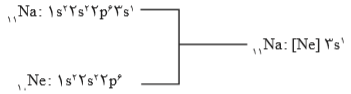
اهمیت آرایش الکترونی فشرده به دلیل نمایش آرایش الکترونها در بیرونیترین لایه به نام لایه ظرفیت اتم است. لایهی ظرفیت یک اتم، لایهای است كه الکترونهای آن، رفتار شیمیایی اتم را تعیین میكند. به الکترونهای این لایه، الکترونهای ظرفیت اتم میگویند.
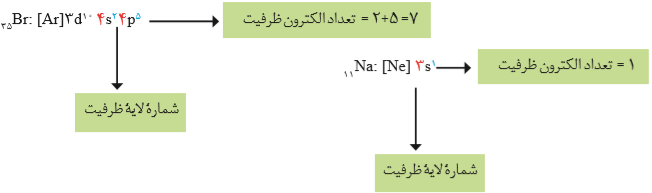
آرایش الکترونی کروم و مس
آرایش الکترونی کروم و مس به صورت زیر است:
24Cr:[Ar]3d54s1
29Cu:[Ar]3d104s1
آرایش این دو عنصر از اصل آفبا پیروی نمیکنند. چون آرایش نیمهپر d5 از d4 و آرایش پر d10 از d9 پایدار تر است.
تعین شماره گروه و دوره عنصرها
تعین دوره: برای تعین باید ابتدا آرایش الکترونی را رسم کرده و سپس در میان زیر لایهها بزرگترین ضریب زیرلایهها را انتخاب میکنیم.
تعین گروه: دو حالت دارد. یکی اینکه بعد از رسم آرایش الکترونی، به زیرلایههای d و s ختم شود، در این حالت شماره گروه آن عنصر برابر است با مجموع الکترونهای موجود در زیرلایههای s و d.
دوم اینکه بعد از رسم آرایش الکترونی، به زیرلایهی p ختم شود، در این حالت شماره گروه آن عنصر برابر است با توان زیرلایهی p به علاوهی عدد 12.
خب، به بخش آخر از آموزش شیمی دهم فصل اول میرسیم که به عنصرها و پیوندهای شیمیایی بین آنها ارتباط دارد. امیدوارم تا اینجا تمام آموزشها را به خوبی یاد گرفته باشید.
ساختار اتم و رفتار آن
گازهای نجیب در طبیعت به شکل تك اتمی یافت میشوند. این واقعیت بیانگر این است كه این گازها واكنش ناپذیر بوده یا واكنش پذیری بسیار كمی دارند، از این رو پایدارند. مثلا اتم سایر عنصرها، نمیتوانند مانند گازهای نجیب به گونهی تک اتمی در طبیعت باشند چون دارای ناپایداری شیمیایی آنها است. پایداری به معنای این است که، عنصر تک اتم باشد و با عناصر دیگر ترکیب نشود. ناپایداری نیز به معنی این است که عنصر به صورت تک اتمی یافت نشود و برای رسیدن به پایداری باید پیوند ایجاد کنند و به صورت ملوکول درآیند. به آرایش الکترونی چهار گاز نجیب توجه كنید:
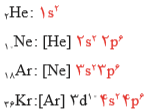
در لایۀ ظرفیت این اتمها، هشت الکترون وجود دارد. با این توصیف میتوان نتیجه گرفت كه بین پایداری و آرایش الکترونی لایۀ ظرفیت اتمها باید رابطهای باشد به طوری كه اگر لایۀ ظرفیت اتمی، همانند آرایش الکترونی یك گاز نجیب و یا هشتتایی باشد، آن اتم واكنش پذیری چندانی ندارد و پایدار است؛ به دیگر سخن اگر لایۀ ظرفیت اتمی چنین نباشد، آن اتم واكنشپذیر و ناپایدار است. تمام عناصر به جز گازهای نجیب، به دستیابی به آرایش الکترونی گازهای نجیب تمایل دارند و به این تمایل قاعده اوکتت یا هشتتایی میگویند.
ساختار لوویس
لوویس برای نمایش لایهی ظرفیت اتمها، مدلی به نام مدل الکترون نقطهای ارائه کرد. برای رسم آرایش الکترون نقطهای هر اتم، میتوان نقطهگذاری را از یك سمت برای مثال از سمت راست نماد شیمیایی عنصر آغاز كرد و نقطههای بعدی را در زیر، سمت چپ و بالای آن قرار داد. الکترون پنجم و پس از آن را باید طوری پیرامون نماد شیمیایی عنصر قرار داد كه هر نقطه به صورت جفت نقطه درآید؛ برای نمونه آرایش الکترون نقطهای اتم های كربن، فسفر و آرگون به صورت زیر است:
![]()
روش رسم ساختار لوویس بسیار راحت و ساده است. تنها راهحل این است که بدانید عنصر مورد نظر در گدام گروه از جدول تناوبی قرار دارد. چون رقم یکان شماره گروه عنصر برابر است با تعداد الکترونهای لایهی ظرفیتی همان اتم. مثلا در اتم برلیم که در گروه 2 جدول یا کربن که در گروه 14 جدول تناوبی قرار دارند، رقم یکان آنها به ترتیب برابر، 2 و 4 است. پس برلیم و کربن به ترتیب دارای 2 و 4 الکترون ظرفیتی هستند.
تبدیل اتمها به یونها
هرگاه اتمهای سدیم و كلر كنار یکدیگر قرار گیرند، اتم سدیم با از دست دادن یك الکترون به یون سدیم و اتم كلر با گرفتن یك الکترون به یون كلرید تبدیل و در این واكنش سدیم كلرید (نمك خوراكی) تولید میشود.
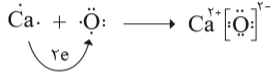
اتم اكسیژن برای رسیدن به آرایش گاز نجیب پس از خود باید دو الکترون بگیرد درحالی كه اتم كلسیم باید دو الکترون ظرفیت خود را از دست بدهد تا به آرایش پایدار گاز نجیب پیش از خود برسد؛ به دیگر سخن هرگاه اتمهای این دو عنصر در شرایط مناسب در كنار هم قرار گیرند، با هم واكنش می دهند به طوری كه با دادوستد الکترون به یون های Ca2+ و O2- تبدیل میشوند.
میان یونهای تولید شده به دلیل وجود بارهای الکتریکی ناهمنام، نیروی جاذبۀ بسیار قوی برقرار می شود، نیروی جاذبهای که پیوند یونی نامیده میشود. ترکیب حاصل از این واكنش، كلسیم اكسید نام دارد كه آن را با فرمول شیمیایی CaO نشان میدهند. این فرمول شیمیایی نشان میدهد كه كلسیم و اكسیژن دو عنصر سازندۀ این تركیباند و نسبت یونهای سازندۀ آن 1 به 1 است. تركیبهایی از این دست كه ذرههای سازندۀ آنها یون است، ترکیب یونی نام دارند.
اگر اتمی در لایهی ظرفیت خود 3 تک الکترون داشته باشد، میتواند با مبادله الکترون به آرایش گازنجیب نزدیک به خود برسد. مثلا اتمهای گروههای یک و دو و سه در نزدیکی اتمهای گروههای پانزده و شانزده و هفده قرار بگیرند، میتوانند باهم الکترون به اشتراک بذارند.
برای نوشتن نام ترکیبهای یونی باید عنصر کاتیون را در سمت چپ و عنصر آنیون را در سمت راست قرار دهیم و سپس هر بار را به زیروند یون کناری بدهیم. هیچوقت عدد یک را برای زیروند عنصر نمینویسیم.
تبدیل اتمها به ملوکولها
بسیاری از تركیبهای شیمیایی در ساختار خود هیچ یونی ندارند و ذرههای سازندۀ آنها مولکولها هستند. گاز كلر، كه خاصیت رنگ بری و گندزدایی دارد از مولکول های دو اتمی Cl2 تشکیل شده است. با توجه به آرایش الکترون نقطهای اتم كلر میتوان تشکیل این مولکول را به صورت زیر نشان داد:
![]()
با این توصیف هر اتم كلر، تك الکترون خود را با دیگری به اشتراک میگذارد به طوری كه دو الکترون موجود بین دو اتم در آرایش الکترون نقطهای به هر دوی آنها تعلق دارد. در این وضعیت هر یك از اتمها به آرایش هشتتایی رسیده است. پیوند حاصل از به اشتراک گذاشتن الکترونهای ظرفیتی دو اتم، را پیوند کوالانسی میگویند؛ که بین نافلزها تشکیل میشود.
خب دوستان خوب و عزیز پایه دهم و معلمان پرتلاش به پایان بحث آموزش فصل اول شیمی دهم رسیدیم و تمامی سعی من این بوده که بتوانم با سادهترین زبان و کوتاهترین زمان ممکن، مباحث این فصل را در اختیار شما عزیزان قرار دهم؛ امیدوارم نهایت استفاده را برده باشید. برای مطالعه سایر فصول شیمی دهم به لینک قرار داده شده مراجعه کنید. همچنین برای مشاهده سایر مطالب مربوط به دروس پایه دهم لینک قرار داده شده را دنبال کنید.
برای اطلاع از بروزترین و داغترین مطالب و مقالات آموزشی ما، حتمأ در قسمت خبرنامه سایت بخون ثبت نام کنید و برای ایجاد دلگرمی و قوت قلب ما از قسمت ارسال دیدگاهها و نظرات، سوالات، نظرات و پیشنهادات خود را بنویسید و برای افزایش کیفیت کار ما، انتقادات خود را نیز بیان کنید.
راستی ما در سایت بخون یک بانک از نمونه سوالات استاندارد برای شیمی هم تدوین کرده و بهصورت رایگان در اختیارتان قرار دادهایم، برای دسترسی میتوانید از لینکهای زیر استفاده کنید:
نمونه سوال شیمی دهم نوبت دوم با جواب
سوالات متداول
- در این مقاله چه مباحثی آموزش داده شده است؟
تمام مباحث مربوط به فصل اول شیمی دهم تجربی به صورت کامل تدریس شده است. - این مقاله دارای تصویر است؟
در این مقاله تصاویر همراه با توضیحات آمده است که یادگیری را راحتتر میکند. - با خواندن این مطلب میتوان فصل اول شیمی دهم را به طور کلی آموخت؟
بله، همچنین با خواندن این مطلب و یادگیری آن در امتحان 20 بگیرید.