در بخش قبلی آموزش فصل اول شیمی یازدهم را تقدیم شما عزیزان کردیم؛ امروز هم با آموزش فصل دوم شیمی یازدهم یعنی در پی غذایی سالم، در خدمت شما عزیزان هستیم. فصل دوم شیمی یازدهم به صورت مفصل درباره گرمای واکنش است که آنرا با اسامی گرماشیمی یا آنتالپی میشناسیم. مفاهیم این درس هم در امتحان یازدهم و هم در کنکور از ارزش بالایی برخوردار است.
ارزش فصل دوم شیمی یازدهم در کنکور هم حدود 4 تست از بودجهبندی این درس است. اما نگران نباشید، من ستوده حیرانی هستم و امروز در سایت بخون به سادهترین زبان ممکن، در تدریس فصل دوم شیمی یازدهم، در اختیار شما عزیزان قرار خواهم داد و فقط نیاز است که وقت بگذارید و تا انتها این مقاله با من همراه باشید. در ضمن در هر بخش از مقاله در صورتی که برای شما سوالی پیش آمد حتما از بخش نظرات با ما در میان بگذارید.
مفهوم انرژی و ماده
دانشمندان اجزای بنیادی جهان مادی را ماده و انرژی میدانند. انرژی از راههای گوناگون با ماده ارتباط دارد؛ برای مثال کاهش جرم در خورشید که تنها منبع حیاتبخش انرژی است، تبدیل ماده به انرژی را تایید میکند.
غذا همواره نقش محوری در رشد، تندرستی و زندگی انسان داشته است. افزایش جمعیت جهان عاملی تعیینکننده برای تامین غذا بوده و هست. بهطوری که امروزه تامین غذای حدود 7.5 میلیارد نفر ساکن کره زمین بسیار پیچیده است از اینرو باید حجم انبوهی از غلات، حبوبات، مواد پروتئینی و … تولید شود.
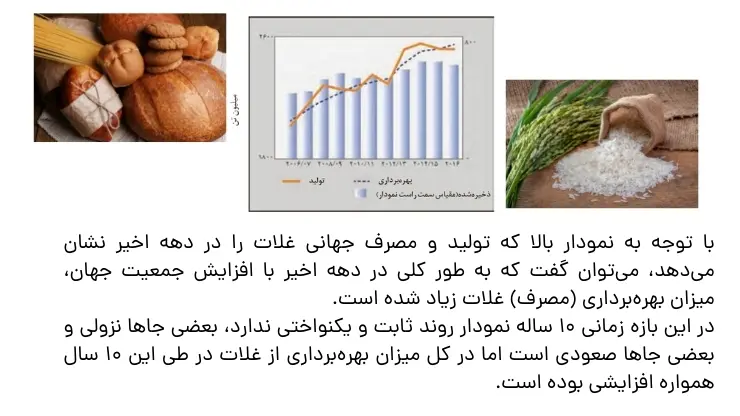
- با پیشرفت دانش و فناوری، تولید فراوردههای کشاورزی و دامی افزایش یافته و غذا به روش صنعتی تولید میشود. در تولید انبوه، به دلیل فساد مواد غذایی و دشواری نگهداری آنها، حفظ کیفیت و ارزش مواد غذایی بسیار مهم است.
- به مجموعه حوزههایی که طی آن مواد غذایی تولید، برداشت و فراوری شده و برای مصرف نهایی آماده میگردد، صنایع غذایی گفته میشود. در این صنعت همانند دیگر صنایع، منابع شیمیایی، سطح وسیعی از زمینها بایر و حجم زیادی از آبهای قابل استفاده در کشاورزی (آب شیرین) مصرف میشود.

اگر به دنبال منبعی مناسب برای ترجمه درس های عربی یازدهم و همچنین حل تمرین های عربی یازدهم هستید، حتما لینک معنی درس های عربی یازدهم و معنی درس های عربی یازدهم را باز کنید تا کاملترین ترجمه را از درس های عربی یازدهم و پاسخ تمرینات این پایه داشته باشید.
بدن برای انجام فعالیتهای خود به ذرههای مختلفی از جمله اتمها، مولکولها یا یونها احتیاج دارد. بخش عمده این ذرهها در بدن ما، از غذایی که میخوریم، تامین میشود.
بدن ما برای انجام فعالیتهای ارادی و غیرارادی مختلف به ماده و انرژی نیاز دارد؛ البته انرژی مواد غذایی یکسان نیست. انرژی هر ماده غذایی به نوع ماده و مقدار آن بستگی دارد.
تفاوت دما و انرژی گرمایی شیمی یازدهم
نوشیدن چای داغ و آب خنک به ترتیب در هوای سرد و هوای گرم، لذتبخش است. در این تجربههای خوشایند (داغی یا خنکی نوشیدنی) و (سردی یا گرمی هوا) نشانهای از تفاوت میان دمای آنهاست، کمیتی که میزان گرمی و سردی مواد را نشان میدهد. اما انرژی گرمایی چیست؟ امروز میخواهیم در این مقاله تفاوت دما و انرژی گرمایی شیمی یازدهم را با هم به طور کامل بررسی کنیم.
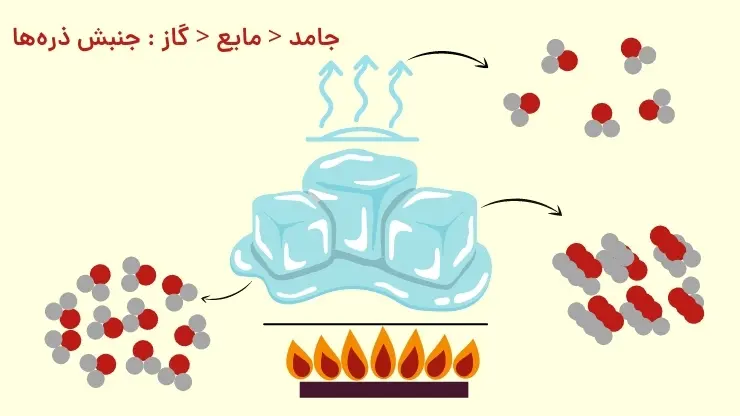
با توجه به شکل بالا با اینکه ذرههای سازنده یک ماده در سه حالت فیزیکی یکسان بوده و پیوسته در جنبوجوش هستند اما میزان جنبش ذرهها متفاوت از یکدیگر است، بهطوری که جنبشهای نامنظم ذرهها در حالت گاز شدیدتر از مایع و آن هم شدیدتر از حالت جامد است. همچنین هر چه دما بالاتر باشد، جنبشهای نامنظم ذرههای آن شدیدتر است. برای نمونه این جنبشها در آب گرم شدیدتر از آب سرد است.
✅ هر چه دمای یک ماده بالاتر باشد، جنبشهای نامنظم ذرههای آن شدیدتر است؛ به همین دلیل بوی غذای گرم آسانتر و سریعتر از غذای سرد به مشام میرسد.
✅ دما و انرژی گرمایی هر دو برای توصیف یک نمونه ماده به کار میروند، ولی گرما از ویژگیهای یک نمونه ماده نیست. تغییر دما و گرما هر دو برای توصیف یک فرایند بهکار میروند.
دانستیم که ویژگی مشترک همه مواد، وجود جنبشهای نامنظم ذرههای سازنده آنها در دمای معین است. هر چه دمای یک ماده بالاتر باشد، میانگین تندی و انرژی جنبشی ذرههای سازنده آن بیشتر است. دمای یک ماده تعیینکننده موارد زیر است.
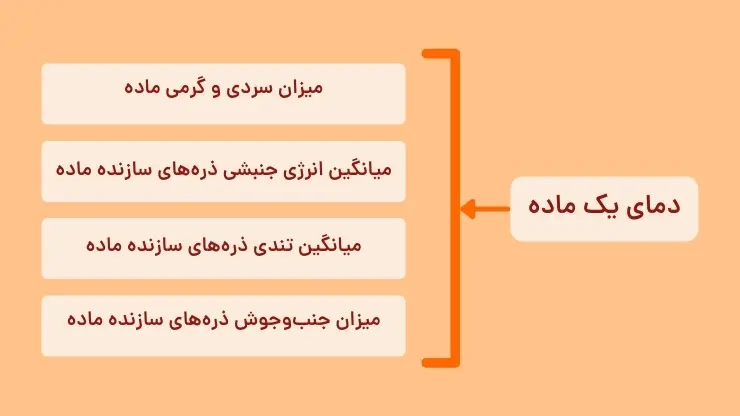
✅ یکای رایج دما، درجه سلسیوس (C°)، در حالی که یکای دما در SI کلوین (K) است. نماد دما برحسب سلسیوس، (θ)و نماد دما برحسب کلوین، (T)است.
آموزش انرژی گرمایی شیمی یازدهم
به مجموع انرژی جنبشی ذرههای سازنده یک ماده، انرژی گرمایی آن ماده میگویند. انرژی گرمایی به دما و تعداد ذرههای سازنده ماده یعنی جرم بستگی دارد.
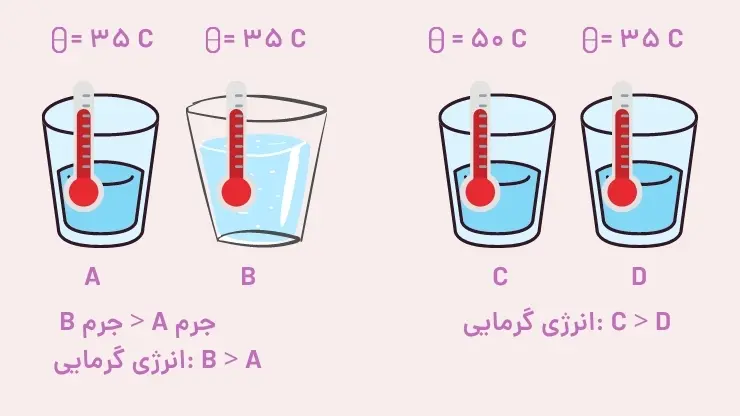
اگر تعداد ذرههای سازنده دو نمونه از یک ماده برابر باشد، نمونهای که دمای آن بیشتر است، انرژی گرمایی بیشتری دارد. و اگر دمای دو نمونه از یک ماده برابر باشد، نمونهای با تعداد ذرههای سازنده بیشتر، انرژی گرمایی بیشتری دارد. به تصویر زیر دقت کنید تا این نکته را به خوبی متوجه شوید.
اگر میخواهید جواب کامل و تشریحی فعالیتهای زیست یازدهم را به صورت یکجا به دست بیاورید، کافیست تا لینک جواب فعالیتهای زیست یازدهم را باز کنید.
خلاصه تفاوت دما و گرما شیمی یازدهم
- دما میانگین انرژی جنبشی است درحالی که گرما مجموع انرژی جنبشی ذرههای سازنده ماده است.
- دما میزان سردی و گرمی را نشان میدهد، درحالی که گرما صورتی از انرژی است.
- دما مستقل از مقدار ماده است، درحالی که گرما به مقدار ماده وابسته است.
- یکای اندازهگیری دما، در SI درجه سلسیوس یا کلوین است. اما یکای اندازهگیری گرما، در SI ژول یا کالری است.
✅ ارزش دمایی (1 C°) برابر با (1 K)است؛ از اینرو، در فرایندهایی که دما تغییر میکند، (ΔT=Δθ)خواهد بود.
گرما و یکاهای آن
به آن مقدار انرژی گرمایی که به دلیل تفاوت در دما جاری میشود، گرما میگویند. گرما را با نماد (Q) نشان میدهند. یکای اندازهگیری گرما در SI ژول (J) است. در بعضی مواقع از کالری (cal) هم برای بیان مقدار گرما استفاده میشود.
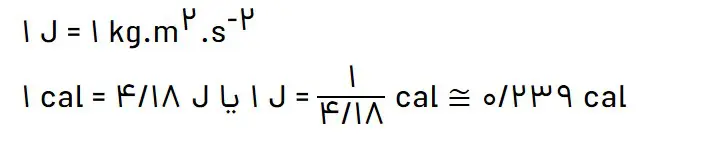
ظرفیت گرمایی و گرمای ویژه شیمی یازدهم
به مقدار گرمای مورد نیاز برای افزایش دمای یک جسم به اندازه یک درجه سلسیوس، ظرفیت گرمایی آن جسم میگویند.
مقدار گرمایی را که برای افزایش دمای یک گرم از ماده به اندازه یک درجه سلسیوس لازم است، گرمای ویژه مینامند.
فرمول ظرفیت گرمایی و گرمای ویژه شیمی یازدهم

رابطه بین ظرفیت گرمایی و گرمای ویژه شیمی یازدهم

تفاوت بین ظرفیت گرمایی و گرمای ویژه شیمی یازدهم
ظرفیت گرمایی به دما، فشار و نوع ماده و مقدار آن بستگی دارد. به عبارتی ظرفیت گرمایی در دما و فشار اتاق، علاوه بر نوع ماده به مقدار آن نیز بستگی دارد. اما گرمای ویژه، در دما و فشار اتاق، تنها به نوع ماده وابسته است. از آنجا که گرمای ویژه همواره به ازای یک گرم ماده است، پس گرمای ویژه به مقدار ماده بستگی ندارد.
جاری شدن انرژی گرمایی
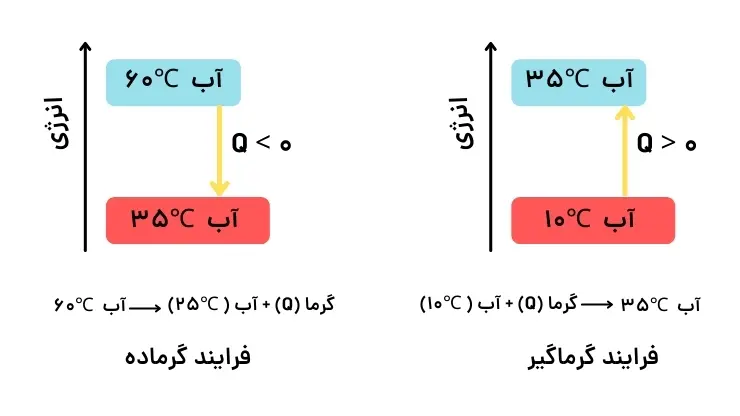
ظرف آبی را در نظر بگیرید که دما آن 60 درجه سانتیگراد است. آن را در اتاقی با دمای 35 درجه سانتیگراد قرار میدهیم. بعد از مدتی مشاهده میکنیم که آب مقداری انرژی به شکل گرما از دست میدهد تا با اتاق همدما شود. در اینجا ظرف آب را سامانه و اتاق را محیط مینامیم.
✅ یکی از راههای تغییر انرژی یک سامانه و مبادله انرژی بین سامانه و محیط، انتقال گرما است.
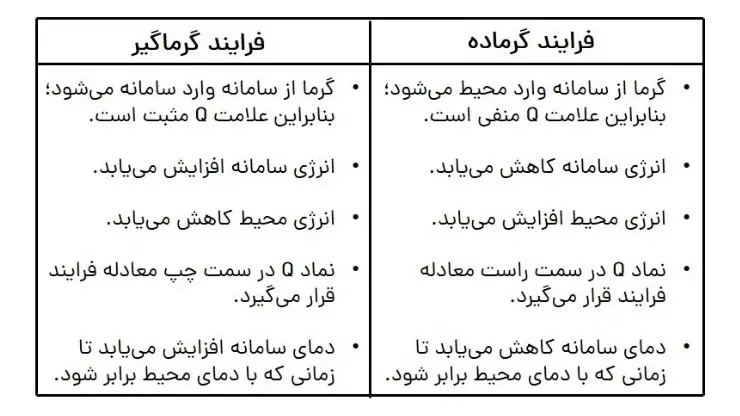
اگر دمای سامانه از محیط اطرافش بیشتر باشد، گرما از سامانه به محیط پیرامون منتقل میشود؛ یعنی سامانه گرما از دست میدهد که در این حالت علامت گرما منفی است. و دمای سامانه کاهش مییابد.
اگر دمای محیط از دمای سامانه بالاتر باشد، گرما از محیط پیرامون به سامانه منتقل میشود؛ یعنی سامانه گرما جذب میکند و علامت گرما مثبت است. برخلاف حالت قبل در اینجا دمای سامانه افزایش مییابد.
✅ این مبادله گرما تا زمانی انجام میشود که سامانه و محیط همدما شوند.
به فرایندهایی که درآنها Q<0 (منفی) است، یعنی سامانه گرما از دست میدهد، فرایندهای گرماده میگویند. همچنین به فرایندهایی که Q>0 (مثبت) است، یعنی سامانه گرما جذب میکند، فرایندهای گرماگیر میگویند. در فرایندهای گرماده، Q سمت راست معادله و در فرایندهای گرماگیر Q سمت چپ معادله نوشته میشود.
ترموشیمی چیست شیمی یازدهم
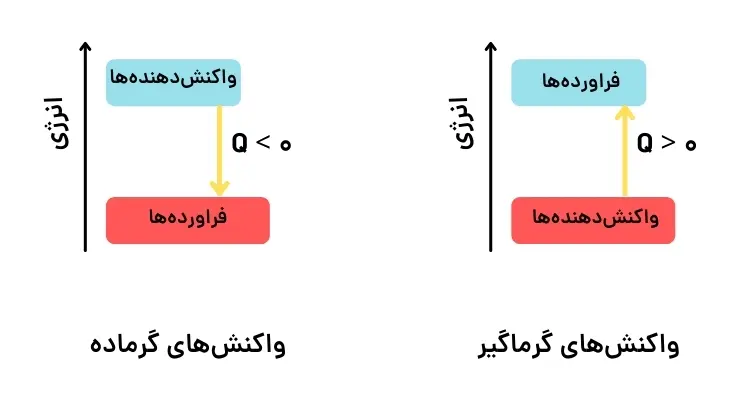
در آموزش شیمی دهم خواندیم که هر واکنش شیمیایی ممکن است با تغییر رنگ، تولید رسوب، آزاد شدن گاز و ایجاد نور و صدا همراه باشد اما یک ویژگی بنیادی در همه آنها داد و ستد گرما با محیط پیرامون است. از این رو هر واکنش شیمیایی ممکن است گرماده یا گرماگیر باشد. بررسی و مطالعه این ویژگی در واکنشها، منجر به پیدایش ترموشیمی (گرماشیمی) شد.
به شاخهای از علم شیمی که به بررسی کمی و کیفی گرمای واکنشهای شیمیایی، تغییر آن و تاثیری که بر حالت ماده دارد، میپردازد، ترموشیمی یا گرماشیمی میگویند.
واکنشها نیز بر اساس اینکه در آنها گرما آزاد شده یا گرما جذب شده باشد، به دو دسته تقسیم میشوند:
در لینک آزمایشگاه علوم تجربی یازدهم، مقالاتی وجود دارد که شامل پاسخ به همه تمرینات کتاب آزمایشگاه یازدهم میباشد، پس حتما آن را دنبال کنید.
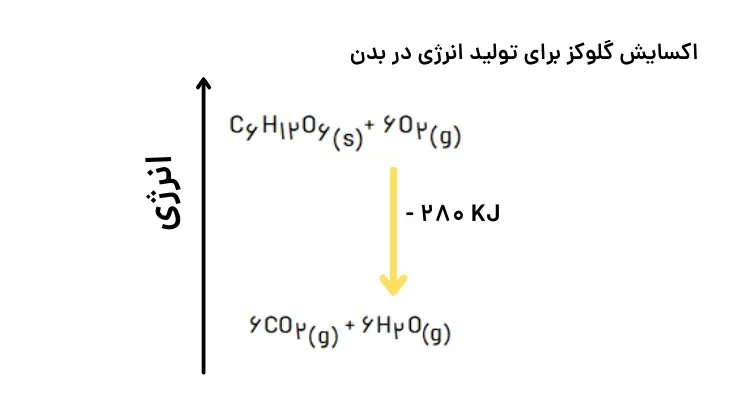
با وجود تولید انرژی در واکنش اکسایش گلوکز، دمای بدن تغییر محسوسی نمیکند، زیرا دمای مواد واکنشدهنده پیش از آغاز واکنش با دمای مواد فراورده پس از پایان واکنش برابر است. در واقع واکنش در دمای ثابت انجام میشود.
هر چند در اغلب فرایندهای گرماده، دمای سامانه کاهش و در اغلب فرایندهای گرماگیر دمای سامانه افزایش مییابد، اما فرایندهای گرماده و گرماگیری هم وجود دارند که طی آنها، دما بدون تغییر است.
برای جمعبندی فرایندهای گرماگیر و گرماده، به جدول زیر دقت کنید.
فرایند سوختوساز مواد غذایی در بدن، از جمله این فرایندها است.
حالا برای اینکه این مساله را بهتر درک کنیم، به مثال زیر توجه کنید.
واکنش میان مولکولهای دو اتمی را بررسی میکنیم. سامانهای محتوی یک مول گاز هیدروژن و یک مول گاز کلر را با دمای 25 درجه سانتیگراد در نظر بگیرید. با انجام واکنش میان آنها افزون بر گاز هیدروژنکلرید، گرمای زیادی نیز تولید میشود. آزمایش نشان میدهد هنگامی که دمای سامانه پس از انجام واکنش به 25 درجه سانتیگراد میرسد، گرمای اندازهگیری شده پس از تولید دو مول گاز هیدروژن کلرید، برابر 184 کیلو ژول میباشد.
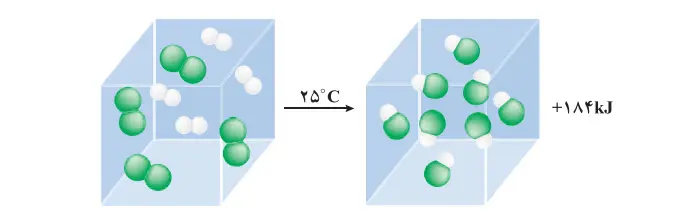
پژوهشها نشان میدهد که این مقدار گرمای آزادشده ناشی از تفاوت انرژی گرمایی (مجموع انرژی جنبشی ذرهها) در مواد واکنشدهنده و فراورده نیست! زیرا در دمای ثابت، تفاوت چشمگیری میان انرژی گرمایی آنها وجود ندارد. شیمیدانها گرمای جذب یا آزادشده در هر واکنش شیمیایی را به طور عمده وابسته به تفاوت میان انرژی پتانسیل مواد واکنشدهنده و فراورده میدانند. با این توصیف، انرژی پتانسیل یک نمونه ماده، انرژی نهفتهشده در آن است، انرژیای که ناشی از نیروهای نگهدارنده ذرههای سازنده آن است.
برای درک این مفهوم، به ساختار مولکولهای گازی مواد شرکتکننده در واکنش زیر توجه کنید.
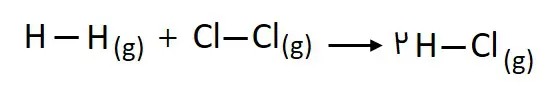
در هر مولکول از این مواد، تنها دو اتم با یک پیوند اشتراکی به یکدیگر متصلاند، اما نوع اتمهای متصل به هم در هر مولکول متفاوت از دیگری است؛ به دیگر سخن نیروهای نگهدارنده اتم در هر مولکول و در نتیجه استحکام پیوندها از یکدیگر متفاوت خواهد بود. اتصال اتمها به این الگو نشان میدهد که با انجام یک واکنش شیمیایی و تغییر در شیوه یکدیگر، تفاوت آشکاری در انرژی پتانسیل وابسته به آنها ایجاد میشود؛ تفاوت انرژیای که در واکنشها به شکل گرما ظاهر میشود.
یخچال صحرایی شیمی یازدهم
در این قسمت با یخچال صحرایی آشنا میشود. این یخچال همانند یخچالهای معمولی است با این تفاوت که بدون نیاز به انرژی الکتریکی، غذا را خنک و برای مدت طولانی نگه میدارد. اما چطور؟
این یخچال همانطور که در شکل زیر میبینید، از دو ظرف سفالی ساخته شده از خاک رس، تشکیل شده است که فضای بین آنها با شن خیس پر میشود. درپوش این یخچال، پارچهای نخی و مرطوب است که هوا را به آسانی تهویه میکند.
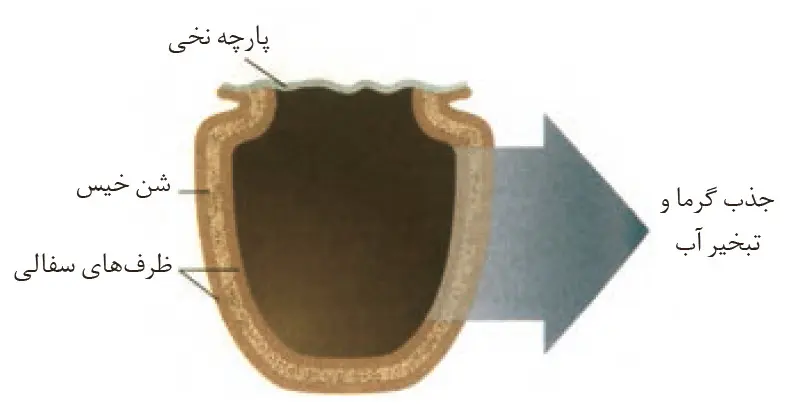
تبخیر آب از سطح بیرونی ظرف سفالی طبق واکنش زیر انجام میشود که باعث جذب گرما و کاهش دمای محفظه درون ظرف شده و به این ترتیب غذای درون آن را خنک نگه میدارد. این معادله نشان میدهد که برای تبخیر یک مول آب به 1/44 کیلوژول گرما نیاز است.
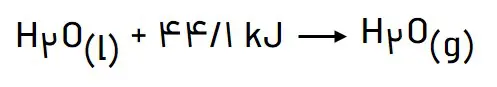
آنتالپی چیست؟ شیمی یازدهم
همانطور که در قسمتهای قبل از آموزش فصل دوم شیمی یازدهم خواندیم، هر نمونه ماده از تعداد زیادی ذره تشکیل شده است که هر یک از این ذرهها دارای انرژی جنبشی و انرژی پتانسیل هستند.
شیمیدانها به انرژی کل سامانهای که محتوی یک نمونه ماده است، محتوای انرژی یا آنتالپی میگویند. آنتالپی را با نماد H نشان میدهند.
✅ همه مواد پیرامون ما در دما و فشار اتاق، آنتالپی معینی دارند.
✅ آنتالپی یک ماده، یعنی محتوای انرژی آن، در دما و فشار ثابت به مقدار ماده و حالت فیزیکی آن وابسته است.
✅ با انجام واکنش شیمیایی گرماگیر در یک سامانه، مواد با محتوای انرژی (آنتالپی) کمتر به موادی با انرژی (آنتالپی) بیشتر تبدیل میشوند.
انجام واکنش فتوسنتز، برخلاف اکسایش گلوکز با جذب انرژی همراه است. از آنجا که دادو ستد انرژی در واکنشها به طور عمده به شکل گرما ظاهر میشود، شیمیدانها تغییر آنتالپی هر واکنش را همارز با گرمایی میدانند که در فشار ثابت با محیط پیرامون دادوستد میکند و آنرا با Qp نشان میدهند.
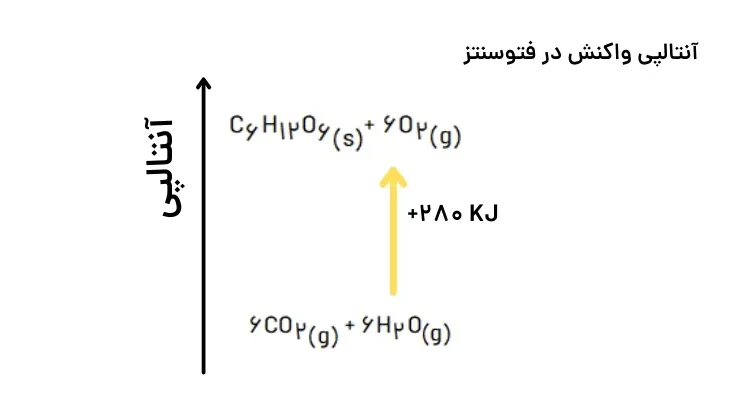
نماد آنتالپی، H است در حالیکه نماد تغییر آنتالپی، H∆ میباشد؛ کمیتی که با رابطه زیر بیان میشود:
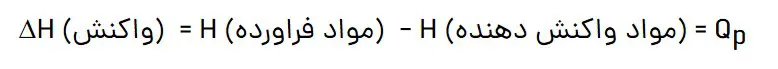
✅ برای یک واکنش اغلب به جای تغییر آنتالپی واکنش، واژه آنتالپی واکنش به کار میرود.
آنتالپی پیوند و میانگین آن شیمی یازدهم
در بخش پاراگراف قبل، از آموزش فصل دوم شیمی یازدهم با آنتالپی واکنش آشنا شدیم که گفتیم همان گرمای دادوستد شده است. حالا میخواهیم به بررسی مبحث آنتالپی پیوند و میانگین آن بپردازیم.
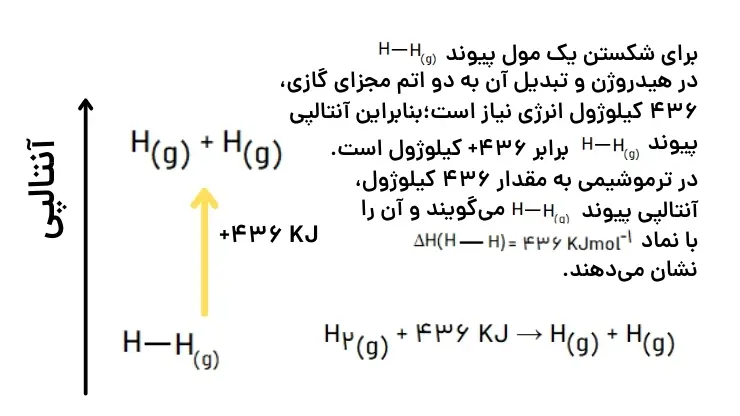
به مقدار انرژی لازم برای شکستن یک مول پیوند اشتراکی یا کووالانسی در حالت گازی و تبدیل آن به اتمهای گازی مجزا، آنتالپی پیوند میگویند. مقدار آنتالپی شکستن پیوند هموار عددی مثبت است و یکای آن کیلوژول بر مول است.
یک نمونه گاز هیدروژن، مجموعهای از شمار بسیار زیادی مولکولهای دواتمی بوده و هر مولکول شامل دو اتم هیدروژن با یک پیوند اشتراکی است. انتظار میرود برای تبدیل این مولکولها به اتمهای جدا از هم انرژی صرف شود.
یافتههای تجربی نشان میدهد که برای مولکولهای چند اتمی به کار بردن میانگنین آنتالپی پیوند مناسبتر است.
محاسبه آنتالپی واکنش شیمی یازدهم
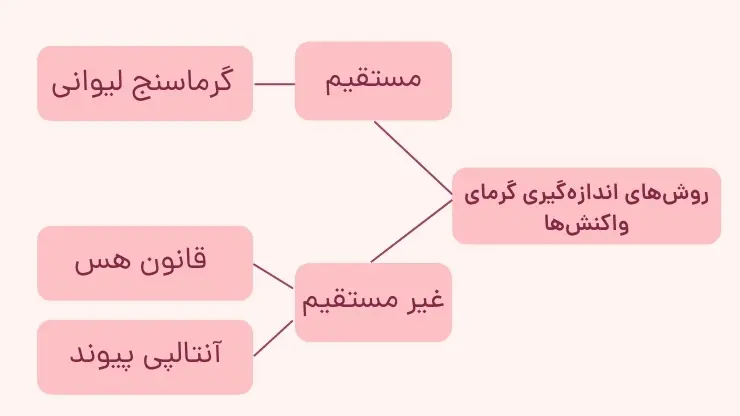
یکی از هدفهای ترموشیمی اندازهگیری گرمای تولید یا مصرفشده در واکنشهای شیمیایی با دقت بالا میباشد. گرمای یک واکنش را میتوان به دو روش مستقیم و غیر مستقیم محاسبه کرد.
اگر به دنبال منبعی خوب برای آموزش فیزیک هستید، مقاله آموزش فصل اول فیزیک یازدهم | الکتریسیته ساکن را مطالعه کنید تا کلی نکات کلیدی در رابطه با این فصل نصیبتان شود.
در روش مستقیم، باید مقداری از واکنشدهندهها را بر هم اثر داد و گرمای مبادله شده را به طور مستقیم اندازهگیری کرد.
آنتالپی بسیاری از واکنشهای شیمیایی را نمیتوان به روش مستقین اندازهگیری کرد؛ زیرا برخی از وکنشها مرحله از یک واکنش پیچیده هستند و یا برخی دیگر به آسانی انجام نمیشوند. به عبارتی تامین شرایط بهینه برای آنها بسیار دشوار است. در این موارد شیمیدانها از روش غیرمستقیم استفاده میکنند.
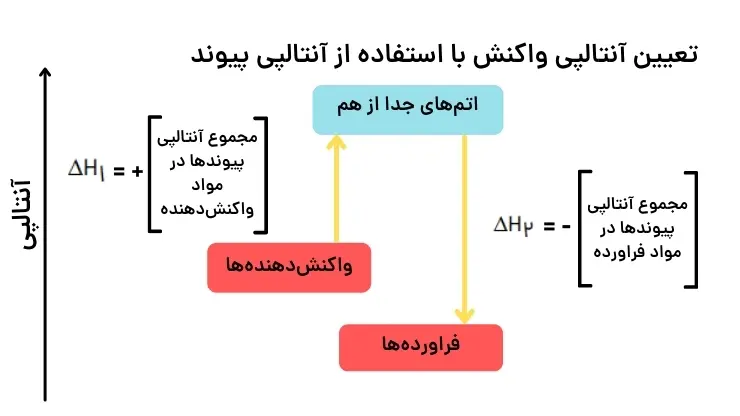
گفتیم که استفاده از آنتالپی پیوند، روشی غیر مستقیم برای تعیین H∆ برخی از واکنشها است.
فرض میکنیم واکنشها در دو مرحله انجام میشوند؛ مرحله اول شامل شکستن همه پیوندهای موجود در واکنشدهندهها و تبدیل آنها به اتمهای گازی مجزا میباشد.
در مرحله بعدی اتمها دوباره با هم پیوند تشکیل میدهند و فراورده را به وجود میآورند. اما محاسبه آنتالپی واکنش چگونه است؟
H∆ مرحله اول همان مجموع آنتالپی پیوندهای موجود در واکنشدهندهها است. اما H∆ مرحله دوم، برابر با منفی مجموع آنتالپی پیوندهای موجود در فراوردهها است؛ زیرا در آن پیوندها دوباره تشکیل میشوند.
فرمول محاسبه آنتالپی پیوند
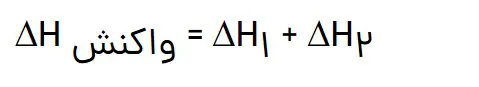
![]()
تعیین آنتالپی واکنش با استفاده از آنتالپی پیوند
آموزش گروههای عاملی شیمی یازدهم
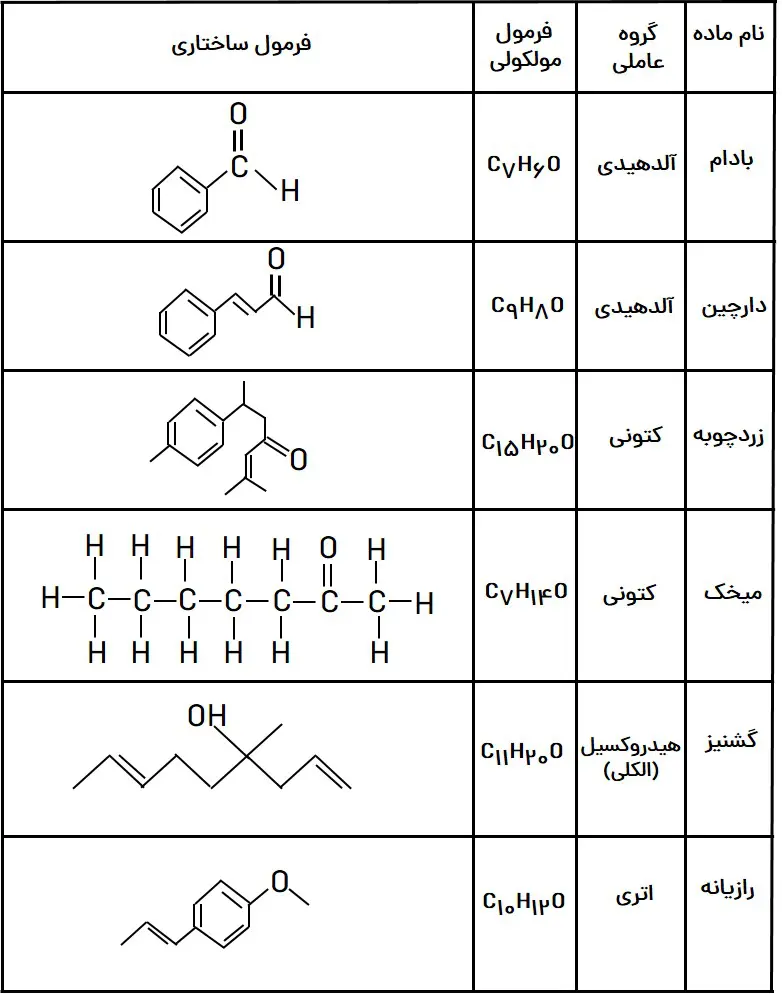
تا الان به رنگ و بوی ادویهها دقت کردهاید؟ ادویهها نقش جالبی در تمدن و تاریخ ملتها دارند بهطوری که بو و مزه لذت بخش غذاهای بومی در هر جای جهان، اغلب به دلیل افزودن ادویههای ویژهای به آنها است. این مواد افزون بر رنگ، بو و مزه خوشایندی که به غذا میدهند، مصرف دارویی نیز دارند آنچنان که امروزه این مواد برای جلوگیری از گرسنگی، افزایش سوختوساز، جلوگیری از التهاب، پیشگیری از سرطان و گاهی بهبود یا رفع آن به کار میروند. در این بخش از مقاله آموزش فصل دوم شیمی یازدهم میخواهیم گروههای عاملی و نقش آنها را بررسی کنیم.
یافتههای تجربی نشان میدهند که رنگ و بوی خوشایند موجود در ادویهها به طور عمده وابسته به ترکیبهای آلی موجود در آنها است؛ ترکیبهایی که در ساختار خود افزون بر اتمهای هیدروژن و کربن، اتمهای اکسیژن، گاهی نیتروژن و گوگرد نیز دارند. شواهد تجربی نشان میدهد که تفاوت در خواص ادویهها بهدلیل تفاوت در ساختار این مواد آلی است. بررسی مواد آلی موجود در آنها نشان میدهد که وجود آرایش ویژهای از اتمها به نام گروه عاملی نقش تعیینکنندهای در خواص آنها دارد. در هر یک از این گروهها شیوه اتصال اتمها به یکدیگر یا پیوند میان آنها اهمیت ویژهای دارد.
گروه عاملی، آرایش منظمی از اتمهاست که به مولکول آلی دارای آن، خواص فیزیکی و شیمیایی منحصر به فردی میبخشد.
✅ شیمیدانها به موادی که فرمول مولکولی یکسان اما ساختار متفاوت دارند، ایزومر (همپار) میگویند.
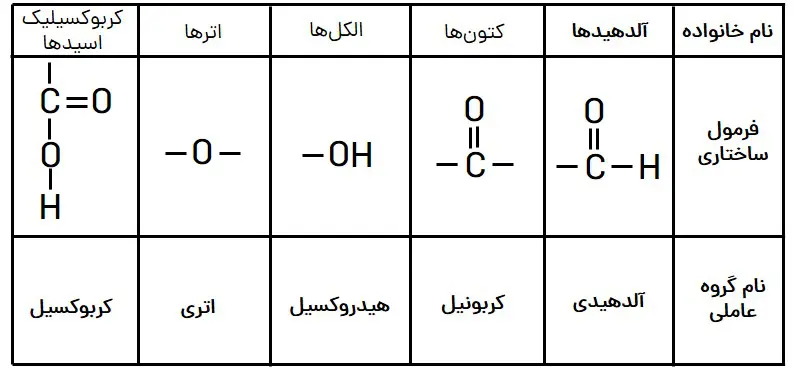
جمعبندی گروههای عاملی
در جدولهای زیر جمعبندی مهمی از گروههای عاملی که قرار است با آنها آشنا شویم را برایتان آوردهام.
در مقاله جواب تکمیل کنید دینی یازدهم پاسخ کامل این قسمت از کتاب دینی یازدهم را بدون نیاز به منابع دیگر مشاهده کنید.
آموزش آنتالپی سوختن شیمی یازدهم
سوختن یکی از مهمترین واکنشهای شیمیایی است که با آزاد شدن انرژی همراه است. در این قسمت از مقاله آموزش فصل دوم شیمی یازدهم میخواهیم بدانیم چطور میتوان از این انرژی آزاد شده استفاده مناسب داشته باشیم و آن را چطور تعریف کنیم.
تهیه هر غذای گرمی به انرژی نیاز دارد، انرژیای که بهطور عمده از واکنش سوختن سوختهای فسیلی تأمین میشود. یکی از این سوختها متان است که بخش عمده گاز شهری را تشکیل میدهد. این ماده در حضور اکسیژن کافی به طور کامل میسوزد و افزون بر CO2 و H2O، مقدار زیادی انرژی تولید میکند. این ویژگی در واکنشهای سوختن باعث شده که سوختهای فسیلی تکیهگاهی برای تأمین انرژی در صنعت، کشاورزی و زندگی روزانه باشند. حالا بر اساس این واکنشها آنتالپی سوختن را به صورت زیر تعریف میکنیم.
انرژی حاصل از سوختن یک مول ماده در اکسیژن خالص و کافی را آنتالپی سوختن آن ماده میگویند.
یکای آنتالپی سوختن KJ/mol است. در ضمن چون آنتالپی سوختن همیشه گرماده است، مقدار آن همواره عددی منفی است.
مقایسه آنتالپی سوختن ترکیبهای آلی
در جدول زیر چند نکته خیلی مهم درباره مقایسه آنتالپی سوختن ترکیبهای آلی برایتان آوردهام. اگر این نکات را در ذهن داشت باشید برای مقایسه آنتالپی سوختن ترکیبات مشکلی نخواهید داشت.

آموزش قانون هس شیمی یازدهم
در بخشهای قبل، از آموزش فصل دوم شیمی یازدهم گفتیم که قانون هس یکی از روشهای اندازهگیری گرمای واکنشها به صورت غیرمستقیم، استفاده از قانون هس است. نخستین بار هنری هس دریافت که گرمای یک واکنش معین به راهی که برای انجام آن در پیش گرفته میشود، وابسته نیست؛ یعنی اگر یک واکنش شیمیایی را به چند روش مختلف انجام دهیم، مقدار DH در همه روشها یکسان بوده و DH فقط به حالت آغازی و پایانی فرایند بستگی دارد. بیان علمی قانون هس بر اساس مفهوم DH به صورت زیر است:
اگر معادله واکنشی را بتوان از جمع معادله دو یا چند واکنش دیگر به دست آورد، DH آن نیز از جمع جبری DH همان واکنشها به دست میآید.
✅ اگر یک واکنش شیمیایی با DH وابسته به آن بیان شود، به آن واکنش گرماشیمی یا ترموشیمیایی میگویند.
میخواهیم به بررسی یک مثال از مسائل قانون هس بپردازیم تا روش حل مسائل قانون هس را به خوبی یاد بگیرید. در این مثال DH واکنش تبدیل آلوتروپ گرافیت به الماس را طبق واکنشهای داده شده حساب میکنیم.
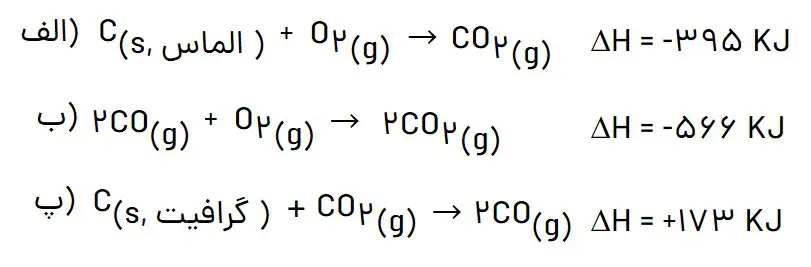
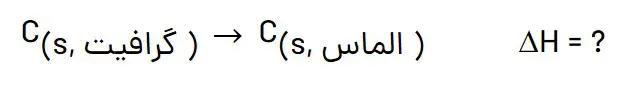

در آموزش فصل اول زیست یازدهم | تنظیم عصبی کاملترین آموزش این فصل را همراه با نکات کنکوری را مطالعه کنید.
گرماسنج لیوانی شیمی یازدهم
یکی از روشهای مستقیم اندازهگیری گرمای واکنشها استفاده از گرماسنج لیوانی است. گرماسنج لیوانی، نمونه سادهای از یک گرماسنج میباشد. گرماسنج لیوانی شامل مقدار معینی آب یا محلول واکنشدهنده در یک ظرف عایقبندی شده است که در آن دماسنج و همزن نیز وجود دارد.
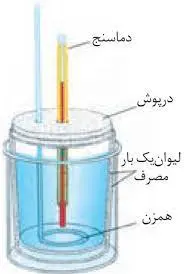
✅ از گرماسنج لیوانی برای اندازهگیری گرمای یک واکنش در فشار ثابت یعنی تغییر آنتالپی واکنش استفاده میشود.
غذای سالم
انسان همواره در طول تاریخ در جستوجوی روشهایی بوده که بتواند ماده غذایی را برای مدتهای طولانیتری سالم نگه دارد و ذخیره کند. برخی از نمونههای افزایش مدت ماندگاری و و نگهداری موادغذایی عبارتاند از:

تجربه نشان میدهد در محیط سرد، خشک و تاریک (مانند سردخانهها) نگهداری انواع مواد غذایی آسانتر از محیط گرم، روشن و مرطوب است. در واقع عوامل محیطی مانند رطوبت، اکسیژن، نور و دما در مدت زمان نگهداری مواد غذایی نقش مهمی دارند.
✅ در محیط مرطوب میکروبها شروع به رشد و تکثیر میکنند تا جایی که ماده غذایی کپکزده و فاسد میشود؛ اما در محیطهای خشک امکان رشد تین جانداران ذرهبینی وجود ندارد؛ به همین دلیل میتوان خشکبار را آسانتر و به مدت طولانیتری در این محیط نگهداری کرد.
اکسیژن گازی واکنشپذیر است و تمایل زیادی برای انجام واکنش با دیگر مواد دارد. براساس این ویژگی، مواد غذایی در هوای آزاد و در معرض اکسیژن، سریعتر فاسد میشوند. وجود پوست و پوشش میوهها و خشکبار یک عامل طبیعی برای افزایش زمان ماندگاری است زیرا مانع از ورود اکسیژن و جانداران ذرهبینی به درون آنها میشود. این ویژگی نشان میدهد که حذف اکسیژن از محیط نگهداری مواد غذایی و خوراکیها سبب افزایش زمان ماندگاری و بهبود کیفیت آنها خواهد شد.
آهنگ واکنش فصل دو شیمی یازدهم
آهنگ واکنش معیاری برای زمان ماندگاری مواد است. کمیتی که نشان میدهد هر تغییر شیمیایی در چه گسترهای از زمان رخ میدهد. هر چه گستره زمان انجام آنها کوچکتر باشد، آهنگ انجام تندتر است و واکنش سریعتر انجام میشود.
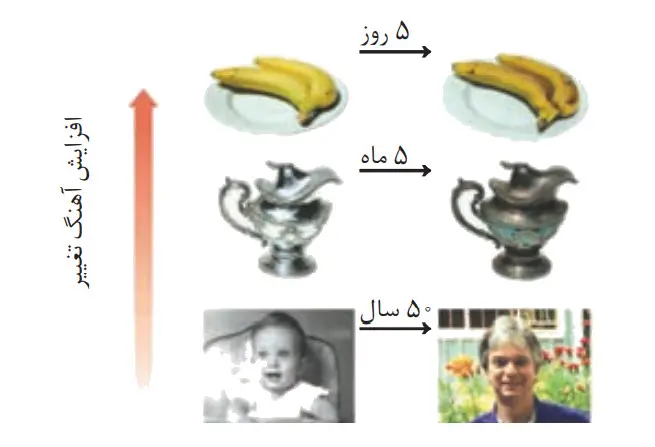
شکل بالا فرایندهایی را نشان میدهد که تفاوت آهنگ انجام آنها آشکار بوده و مقایسه بهصورت کیفی آسان است. شیمیدانها آهنگ واکنش را در گستره معینی از زمان با نام سرعت واکنش بیان میکنند. توجه کنید که گستره زمان انجام واکنشها از چند صدم ثانیه تا چند سده را در برمیگیرد.
نمونه سوال فصل دوم شیمی یازدهم | در پی غذای سالم را باز کنید تا کاملترین و استانداردترین نمونه سوالات این فصل را به صورت رایگان و همراه با پاسخ کاملا تشزحی مشاهده بفرمایید.
در شکلهای زیر انجام برخی از واکنشها در سرعتهای متفاوت را مشاهده میکنید.


عوامل موثر بر سرعت واکنش
اثر دما
هر چه دمای واکنش بیشتر باشد، انرژی جنبشی ذرههای شرکتکننده در واکنش زیاد میشود؛ در نتیجه احتمال برخورد بین ذرات بیشتر شده و سرعت واکنش زیاد میشود.
برای نگهداری طولانی مدت فراوردههای گوشتی و پروتئینی، آنها را به حالت منجمد ذخیره میکنند؛ زیرا با کاهش دما، سرعت فاسد شدن مواد غذایی کاهش مییابد.
اثر غلظت
با افزایش غلظت واکنشدهندهها، تعداد برخوردها افزایش یافته و در نتیجه سرعن واکنش افزایش مییابد.
برای نگهداری سالم برخی خوراکیها، با خالی کردن هوای درون ظرف آنها را بستهبندی میکنند؛ زیرا با کاهش غلظت اکسیژن در ظرف، سرعت فاسد شدن مواد غذایی کاهش مییابد.
اثر کاتالیزگر
کاتالیزگر مادهای است که میتواند سرعت واکنش را تا چند برابر افزایش دهد بدون اینکه در واکنش مصرف شود.
اثر نوع مواد واکنشدهنده
با توجه به نوع مواد واکنشدهنده در واکنش سرعت واکنش فرق میکند؛ برای مثال واکنشپذیری هالوژنها از بالا به پایین، کاهش مییابد. واکنشپذیری فلزهای گروه اول از فلزهای گروه دوم همدوره خود بیشتر است؛ بنابراین واکنش آنها با آب سریعتر خواهد بود.
سطح تماس واکنشدهندهها
هر چه سطح تماس میان ذرههای واکنشدهنده بیشتر باشد، سرعت واکنش بیشتر است. برای مثال تراشههای چوب سریعتر از تکههای چوب میسوزند.
سرعت واکنش شیمی یازدهم
سینتیک شیمیایی شاخهای از علم شیمی است که به بررسی آهنگ تغییر شیمیایی در واکنشها و عوامل موثر بر این آهنگ میپردازد.
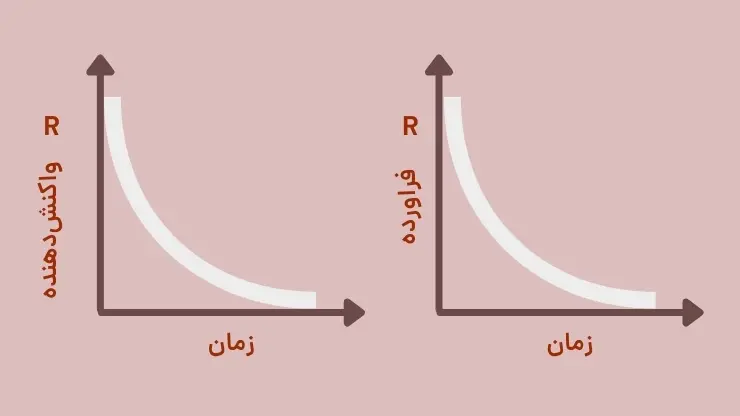
سرعت مصرف با تولید یک ماده شرکتکننده در واکنش در گستره زمانی قابل اندازهگیری را سرعت متوسط آن ماده میگویند و آن را با R نمایش میدهند. از این رو، (R(A سرعت متوسط تولید یا مصرف ماده را نشان میدهد.
سرعت مصرف یا تولید یک ماده شرکتکننده در واکنش را میتوان برحسب تغییر تعداد مولهای آن در واحد زمان بیان کرد.
در یک واکنش، سرعت مصرف واکنشدهندهها و سرعت تولید فراوردهها هر دو با گذشت زمان کاهش مییابند؛ زیرا ر یک واکنش به تدریج با مصرف واکنشدهندهها غلظت آنها کم شده و سرعت واکنش کاهش مییابد. از طرفی سرعت تولید فراوردهها به سرعت مصرف واکنشدهندهها بستگی دارد؛ بنابراین سرعت تولید فراوردهها نیز کاهش مییابد.
فرمول سرعت واکنش
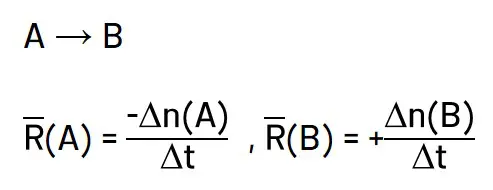
سرعت متوسط واکنش
اگر ضرایب استوکیومتری مواد شرکتکننده در واکنش، یکسان نباشد، سرعت متوسط مصرف یا تولید آنها متفاوت خواهد بود؛ به همیین دلیل شیمیدانها برای درک آسان پیشرفت واکنش در واحد زمان، از مفهئمی بهنام سرعت متوسط واکنش استفاده میکنند.
سرعت متوسط واکنش از تقسیم سرعت متوسط تولید یا مصرف یک ماده شرکتکننده در واکنش بر ضریب استوکیومتری آن، در معادله موازنه شده به دست میآید.
فرمول سرعت متوسط واکنش
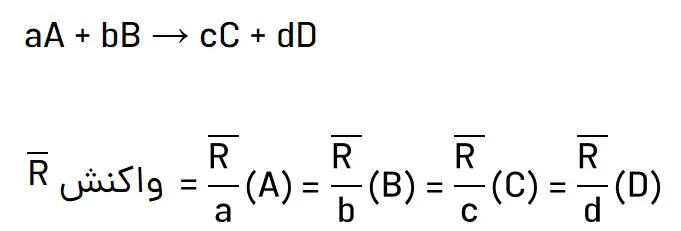
بازدارندهها شیمی یازدهم
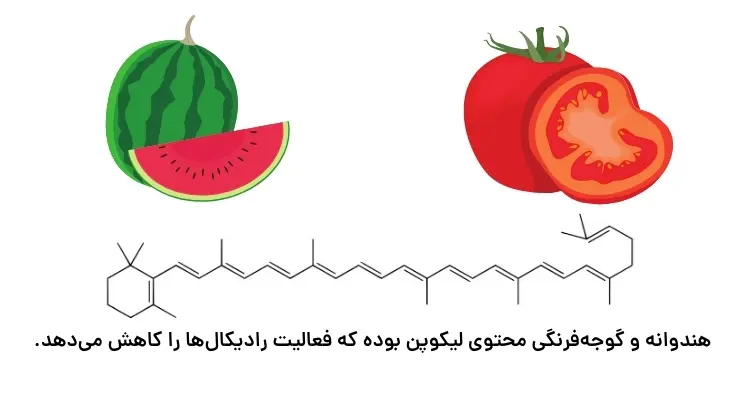
نتیجه پژوهشهای علمی نشان داده که سبزیجات و میوهها، محتوی ترکیبهای آلی سیرنشدهای به نام ریزمغذیها هستند، ترکیبهایی که در حفظ سلامت بافتها و اندامها دخالت دارند، هر چند نقش کامل این مواد هنوز بهطور دقیق مشخص نشدهاست اما برخی از آنها به عنوان بازدارنده از انجام واکنش نامطلوب و ناخواسته بهدلیل حضور رادیکالها جلوگیری میکنند.
رادیکال، گونه فعال و ناپایداری است که در ساختار خود، الکترون جفت نشده دارد، در واقع محتوی اتمهایی است که از قاعده هشتتایی پیروی نمیکنند. بدیهی است که رادیکالها واکنشپذیری بالایی دارند.
در بدن ما بهدلیل انجام واکنشهای متنوع و پیچیده، رادیکالهایی بهوجود میآیند که اگر به وسیله بازدارنده-ها جذب نشوند، میوانند با انجام واکنشهای سریع به بافتهای بدن آسیب برسانند. با این توصیف مصرف خوراکیهای محتوی بازدارندهها سبب خواهد شد که رادیکالها به دام بیفتند تا با کاهش مقدار آنها از سرعت واکنشهای ناخواسته کاسته شود.
جواب تمرینهای آخر فصل کل کتاب شیمی یازدهم را میتوانید در لینک جواب تمرینهای دورهای شیمی یازدهم از فصل 1 تا 3 مشاهده کنید.
ردپای غذا
زندگی ما و ادامه آن بر روی زمین به تأمنین نیازهای ضروری مانند هوا، آب، غذا و… وابسته است. اما میزان نیاز و بهرهمندی از این منابع برای همه یکسان نیست. در شیمی دهم با ردپای کربندیاکسید و آب آشنا شدید. ردپاهایی که دو چهره آشکار و پنهان دارند. پدیده دو چهره دیگری از این دست، ردپای غذا است.

سهم تولید گاز کربندیاکسید در ردپای غذا خیلی بیشتر از سوختن سوختها در خودروها، کارخانهها و … است.
دوستان خوبم به پایان مقاله آموزش فصل دوم شیمی یازدهم رسیدیم. امیدوارم نهایت استفاده را از این آموزش برده باشید و مقاله مورد توجه شما قرار گرفته باشد. اگر میخواهید به مطالب سایر فصلها دسترسی داشته باشید، از طریق لینک آموزش شیمی یازدهم و برای استفاده از نمونه سوالات رایگان از بخش نمونه سوال شیمی یازدهم اقدام کنید. تا مطالب و نکات سایر درسها را از دست ندهید. در ضمن سوالاتی که دارید را از طریق بخش نظرات با ما در میان بگذارید تا سریعا پاسخگو باشیم و با عضویت در خبرنامه بخون در ادامه میتوانید سریع تر از همه، از آخرین اخبار آموزش و بهترین مقالات ما به صورت رایگان مطلع شوید.
سوالات متداول
- تست های فصل اول شیمی یازدهم را از کجا میتوانم پیدا کنم؟
سوالات تستی مربوط به این فصل و سایر فصلها را داخل سایت بخون در قسمت تست شیمی یازدهم برای شما عزیزان گذاشته ایم. - این مقاله شامل حل سوالات داخل کتاب درسی میباشد؟
خیر، اما در قسمت گام به گام شیمی یازدهم جواب کل سوالات و تمرینهای کتاب درسی را میتوانید پیدا کنید.






