شیمی یکی از عناوین کم طرفدار در بین دروس متوسطه دوم میباشد.سختی مباحث شیمی اصلی ترین دلیل بی میلی داوطلبان نسبت به مطالعه مباحث آن است. فصل اول شیمی سال دوازدهم شامل مبحث بسیار مهم و تست خیز اسید و بازها است که عمده داوطلبان با یادگیری مطالب اسید و بازها مشکل دارند که در امتحانات نهایی و ازمون سراسری منجر به از دست دادن نمرات و درصدهای قابل ذکری میشود. من سالار احمدی در این مقاله تحت عنوان آموزش فصل اول شیمی دوازدهم مولکولها در خدمت تندرستی، یادگیری مبحث اسید و بازها را برای شما به امری ساده و لذت بخش تبدیل کردهام، پس برای یادگیری کامل و مفهومی این فصل تا آخر این مقاله در سایت بخون همراه من باشید.
پاکیزگی محیط با مولکولها فصل اول شیمی دوازدهم
در طی زندگی روزمره هر انسان کم و بیش در معرض انواع آلایندهها قرار دارد.
آلایندهها موادی هستند که بیش از مقدار طبیعی در یک محیط، نمونه ماده یا یک جسم وجود دارد. گل ولای آب، گرد و غبار هوا و لکههای چربی مواد غذایی بر روی لباسها و پوست بدن نمونههایی از انواع آنها هستند. در ادامه به برسی نحوهی عملکرد پاککنندهها و سری توضیحات تکمیلی مواد شوینده خواهیم پرداخت.

از شیمی سال دهم بیاد دارید که مواد قطبی در حلالهای قطبی و مواد ناقطبی در حلالهای ناقطبی حل میشوند و یا به عبارتی دیگر شبیه شبیه را در خود حل میکند. در واقع در فرایند انحلال، اگر ذرههای سازنده حل شونده با مولکولهای حلال جاذبههای مناسب برقرار کنند حل شونده در حلال حل میشود و در غیر این صورت ذرههای حل شونده کنار هم باقی میماند.
در انحلال عسل در آب به دلیل وجود مولکولهای قطبی عسل است که در ساختار خود تعداد بیشماری گروه هیدروکسیل دارند و در هنگام انحلال عسل در آب گروههای هیدروکسیل عسل با مولکولهای آب پیوند هیدروژنی برقرار میکنند.
انحلال اتلین گلیکول (ضد یخ) در آب- بعضی از ترکیبات یونی (نمک) -اوره – عسل همهی مواد ذکر شده به علت قطبی بودن در آب حل میشوند.

انحلال بنزین ، روغن زیتون ، وازلین در هگزان که ناقطبی است امکان پذیر میباشد.

چربیها و اسیدهای چرب ناقطبی و نامحلول در آب هستند.
برای پاکسازی چربی و گریس از سطح مواد و یا البسه از صابون و شویندهها استفاده میشود و چربیها را میتوان مخلوطی از اسیدهای چربی و استرهای بلند زنجیر با جرم مولی زیاد دانست.
اسیدهای چرب کربوکسیلیک اسیدهایی با زنجیره کربنی هستند و نیروی بین مولکولی چربیها ناقطبی-ناقطبی میباشد.
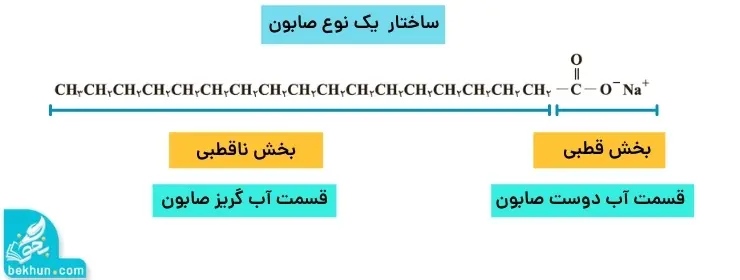
صابون را میتوان نمک سدیم اسید چرب دانست و فرمول همگانی این نوع صابونها که جامد هستند -RCOONa- بوده که در آن -R- یک زنجیره هیدروکربنی بلند است.
صابون جامد را از گرم کردن مخلوط روغنهای گوناگون یا چربی مانند روغن زیتون، نارگیل و پیه گوسفندی با سدیم هیدروکسید تهیه میکنند و صابونهای مایع نمک پتاسیم یا آمونیوم اسیدهای چرب هستند.
صابون مادهای است که در چربی و در آب نیز حل میشود.(امولسیونکننده)
پیوند با زندگی صفحه ۶ | سوسپانسیون و کلوییدها فصل اول شیمی دوازدهم
مخلوطها در زندگی ما نقش قابل ذکری دارند و ما از انواع مختلف مخلوطها برای رفع نیازهای متفاوت استفاه میکنیم.
محلول مس سولفات (کات کبود) در آب مخلوطی همگن است که نور را از خود عبور میدهد که از الکترولیز فلز مس با سولفریک اسیدغلیط بدست میآید و در صنعت و کشاورزی کاربرد فراوانی دارد.
دوستان و همراهان گرامی تمامی فعالیت ها و تمرینات کتاب درسی در قسمت گام به گام شیمی دوازدهم برسی شده و شما به سادگی می توانید از آن ها بهره بگیرید.
سوسپانسیون
به مخلوط جامد در مایعی گفته میشود که ذرات جامد آن به صورت معلق در مایع حضور دارد و مخلوطی نا همگن است که به صورت ناپایدار باقی میماند و در مایع ته نشین خواهد شد مانند: دوغ، شربت معده، آب و خاکشیر که همگی بخشی از انواع سوسپانسیونها هستند.
کلوئید
اگر محلول آب و روغن را باهم مخلوط کنید یک مخلوط ناپایدار بدست میآید که به محض توقف همزن مخلوط ۲ ماده از یکدیگر جدا خواهند شد و دو لایه مجزا تشکیل میشود.
اگر مقداری صابون به این مخلوط اضافه کنیم و آن را ترکیب کنیم یک مخلوط به ظاهر همگن پایدار ایجاد میشود اما رفتار این مخلوط نشان میدهد که همگن نمیباشد و دارای مولکولهایی با اندازهی متفاوت است که این نوع مخلوط را کلوئید مینامیم و نور در کلوئیدها رفتاری متفاوت با محیط محلول دارد.شیر-ژله-چسب-سس انواعی از کلوییدها هستند.

مقایسه ویژگی سوسپانسیون و کلوییدها
| ویژگی | سوسپانسیون | کلویید |
| رفتار در برآبر نور | نور را پخش میکند | نور را پخش می کند |
| همگن بودن | نا همگن | نا همگن |
| پایداری | ناپایدار است | پایدار است |
| ذره های سازنده | ذرههای ریز | توده |
مولکول صابون دو بخش قطبی و ناقطبی دارد و بخش قطبی صابون آب دوست میباشد و بخش ناقطبی ان چربی دوست و آبگریز میباشد.
خب با توجه به این توصیفات صابون پاککننده مناسبی برای چربیها است و طی فرایند پاکسازی مولکولهای چربی توسط صابون بخش چربی دوست صابون مولکولهای چربی را جذب کرده و با مولکولهای آب پیوندی برقرار نخواهد کرد و بدین ترتیب مولکولهای چربی از سطح مورد نظر پاک خواهند شد.
نوع پارچه–دما-جنس آب و مقدار و نوع صابون در میزان پاک کنندگی تاثیرگذار است.
جنس آب یکی از عوامل مهم در میزان پاک کنندگی صابونها میباشد و صابون در آبهای شور و کویر که دارای مقادیر زیادی یون کلسیم و منیزیم استبه خوبی کف نخواهد کرد و از قدرت پاک کنندگی صابون کاسته خواهد شد.
به این نوع از آبهای موجود در خشکی آب سخت میگویند. صابون در این آبها رسوب تشکیل میدهد و به صورت لکههای سفدی بر روی البسه باقی میماند.
در جست و جوی پاککننده های جدید شیمی دوازدهم
تولید صابون با روشهای قدیمی پس از مدتی پاسخگو همهی نیازهای انسانها نبود و برای همه آلایندهها صابون کاربردی نداشت. از این رو دانشمندان برای تهیه پاککنندههای شیمیایی دست به کار شدند و پس از مدتی با بهرهگیری از بنزین و دیگر مواد اولیه صنعتی موفق به ساخت پاککنندههای غیر صابونی شدند.
این مواد طی واکنشهای پیچیده پتروشیمیایی تولید میشوند و دارای قدرت پاک کنندگی بالایی هستند و در آبهای سخت نیز کاربردی هستند و رسوب نخواهند کرد.
در پاک کنندههای غیر صابونی به جای گروه کربوکسیلات گروههای دیگری از جمله گروههای سولفانات قرار گرفته است.
آموزش پیوند با صنعت صفحه ۱۱ شیمی دوازدهم | کاربرد صابونهای گوگردی
صابون طبیعی معروف به صابون مراغه با قدمتی بیش از ۱۵۰ سال معروفترین صابون سنتی ایران است که از جوشیدن پپه گوسفند و سود سوزآور در دیگهای بزرگ آب و خشک کردن آنها در قالبهای بزرگ بدست میآید.
این سری صابونهای طبیعی برای موهای چرب استفاده میشود.
صابونهای گوگردی برای از بین بردن جوشهای پوستی و همچنین قارچهای پوستی استفاده میشوند. برای افزایش خاصیت پاککنندگی صابونها به آنها نمک فسفات اضافه میشود و از تشکیل رسوبات در آبهای سخت جلوگیری میکند و همچنین برای افزایش خاصیت میکروب کشی و ضد عفونی کردن به آنها کلر اضافه میشود.
بهرهگیری از صابونهای قوی به صورت روزمره عوارض جانبی دارد از این رو برای استفادههای بلند مدت از صابونهای ملایم بهره بگیرید.

پاککنندههای خورنده فصل اول شیمی دوازدهم
پاککنندههایی که تا به الان به آنها پرداختیم بر اساس بر همکنش ذرهها عمل میکنند اما پاککنندههایی وجود دارند که افزون بر این بر همکنشها با آلایندهها واکنش میدهند.
رسوبات تشکیل شده در سماور-کتری و لولههای انتقال آب با پاککنندههای عادی تمیز نخواهند شد و این رسوبات به ترکیباتی نیاز دارند که بتوانند با آنها واکنش دهند و آنها را به فراوردههایی تبدیل کنند که با آب ترکیب میشوند.
موادی مانند: هیدروکلریک اسید(جوهر نمک)-سدیم هیدروکسید و سفیدکنندهها از جمله این پاککنندهها هستند که از نظر شیمیایی فعالاند و خاصیت خورندگی دارند از این جهت نباید با پوست تماس مستقیم داشته باشند.
برای باز کردن مجاری مسدود شده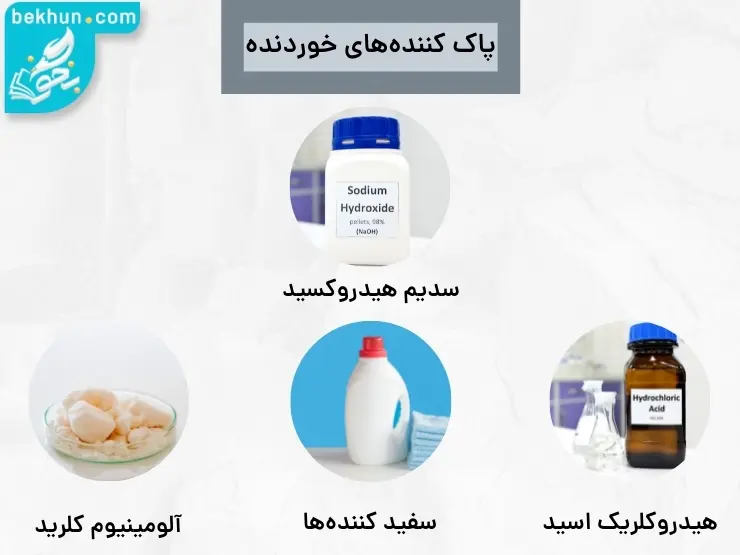 برخی وسایل و دستگاههای صنعتی فلز سدیم هیدروکسید و الومینیوم را به شکل پودر استفاده میکنند.
برخی وسایل و دستگاههای صنعتی فلز سدیم هیدروکسید و الومینیوم را به شکل پودر استفاده میکنند.
آموزش اسیدها و بازها شیمی دوازدهم
هر روز در بخشهای گوناگون زندگی افزون بر شویندهها و پاک کنندهها، مقادیر متفاوتی از مواد شیمیایی گوناگون مصرف میشود که در اغلب آنها اسیدها و بازها نقش مهمی دارن و عملکرد بدن ما نیز به میزان مواد اسیدی و بازی موجود در آن وابسته است.
ویژگی اسیدها
- اسید ها ترش مزهاند
- رنگ شناساگر را قرمز میکنند.
- شامل هیدروژن هستند.
- برخی سمی و برخی برای بدن ضروری هستند.
- خنثی کننده بازها هستند.
- در تماس با پوست بدن سوزش ایجاد میکنند.
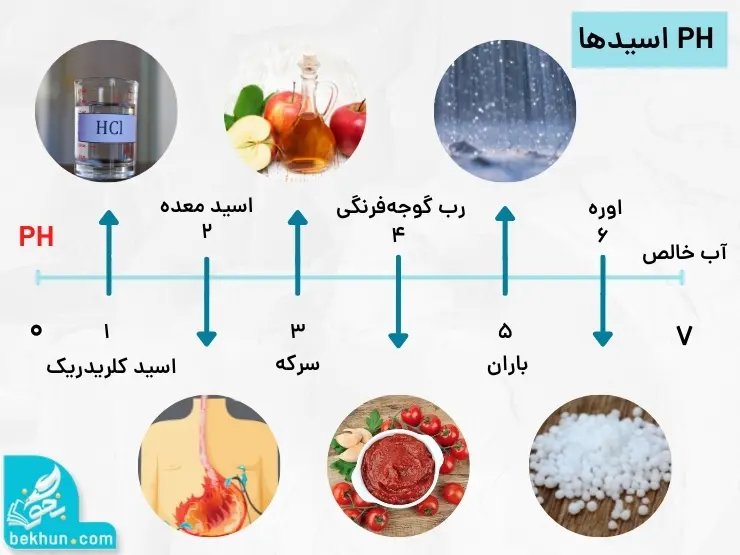
- اسیدها نافلزند .
- PH اسید کمتر از ۷ میباشد.
- جوهرنمک اسیدی است.
اسیدها در تماس با پوست سوزش و حساسیت ایجاد خواهند کرد برای نمونه ریفلاکس اسید معده که سوزشی شدید در ناحیه مری ایجاد خواهد کرد و هرگونه تماس اسید با پوست اندام خارجی بدن نیز موجب سوختگی و سوزش خواهد بود.
هیدروکلریک اسید معده توسط سلولهای دیواره معده که دارای پوششی خاص هستند ترشح میشود و این اسید میتواند به سطح بقیه سلولهای بدن و اندامهای داخلی در صورت تماس ضربه وارد کند و موجب امراض داخلی جدی گردد.
ویژگی بازها
- بازها مزه تلخی دارند.
- رنگ شناساگر را آبی میکنند.
- شامل هیدروکسیل هستند.
- حلال چربی هستند.
- خنثی کننده اسیدها هستند.
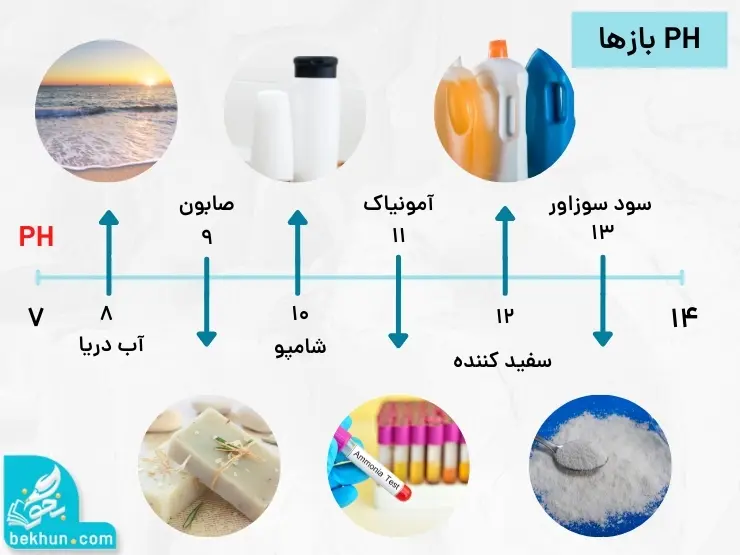
- بازها فلزند.
- PH باز بیشتر از ۷ میباشد.
- صابون قلیایی است.
در تاریخ بارها از خاصیت اسید و بازها بدون شناخت کافی بهره گرفته شده است اما اسید و باز به یک تعریف و مبنای علمی دقیق نیاز داشت.
آرنیوس اولین شخصی بود که اسید و بازها را بر اساس یک مبنای علمی تعریف کرد و وی بر روی رسانایی الکتریکی محلولهای آبی کار میکرد و تجربیات وی نشان داد که اسید و بازها بر رسانایی الکتریکی محلولها تاثیر گذارند و رسانای برق در درجههای رسانایی متفاوتیاند.
آرنیوس اولین کاشف اسید و بازها نبود بلکه اولین کسی بود که اسید و بازها را براساس یک مبنای علمی تعریف کرد.
اسید آرنیوس مواد و ترکیبهایی هستند که با حل شدن در آب غلظت یونهای هیدرونیوم را بیشتر میکنند و میتوان رفتار اسید آرنیوس را براساس غلظت یون H+aq توصیف کرد و بدیهی است هرچه تعداد +H در محلولی بیشتر باشد آن محلول اسیدیتر است.
باز آرنیوس مواد و ترکیباتی هستند که با حل شدن در آب غلظت یون هیدروکسید را افزایش میدهند و رفتار باز آرنیوس را میتوان بر اساس غلظت یونهای oh_aq توصیف کرد و هر چه تعدادoh-در محلولی بیشتر باشد ان محلول بازیتر است.
اگر در سامانهای غلظت یون هیدرونیوم و یون هیدروکسید با هم برآبر باشند ان سامانه در حالت خنثی خواهد بود.
محدودیت اسید و باز آرنیوس برای تشخیص در خارج از محیط آبی یکی از ایرادات این مبنای علمی بود در محیط غیر آبی نمیتوان در مورد اسید و باز بودن محلولها اظهار نظر کرد.

آموزش مبحث رسانایی الکتریکی محلولها و قدرت اسیدی سال دوازدهم
خوراکیها، شویندهها، داروها، مواد آرایشی و بهداشتی شامل مقادیر متفاوتی از یونها به ویژه یون هیدرونیوم هستند. غلظت این یون بر روی ماندگاری این مواد و در نتیجه سلامتی تأثیر شایانی دارد.
برای نمونه شیر سالم با افزایش غلظت یون هیدرونیوم، ترش شده به طوری که دیگر قابل نوشیدن نیست. این نمونه نشان میدهد که در فرایند تولید مواد گوناگون اغلب تعیین و کنترل غلظت یون هیدرونیوم نقش مهمی دارد. یکی از روشهایی که برای تعیین غلظت یون هیدرونیوم میتوان به کار برد، سنجشرسانایی الکتریکی محلولهای آبی است.
فلز و گرافیت رسانای جریان برق هستند و رسانایی آنها توسط الکترونها انجام میشود از این جهت به آنها رسانای الکترونی گفته میشود.
نوعی دیگر از رسانایی توسط یونها انجام میشود و به آن رسانایی یونی گفته میشود که شرط رسانایی یونی حرکت یونها است زیرا با حرکت یونها الکترونها نیز جا به جا میشوند.
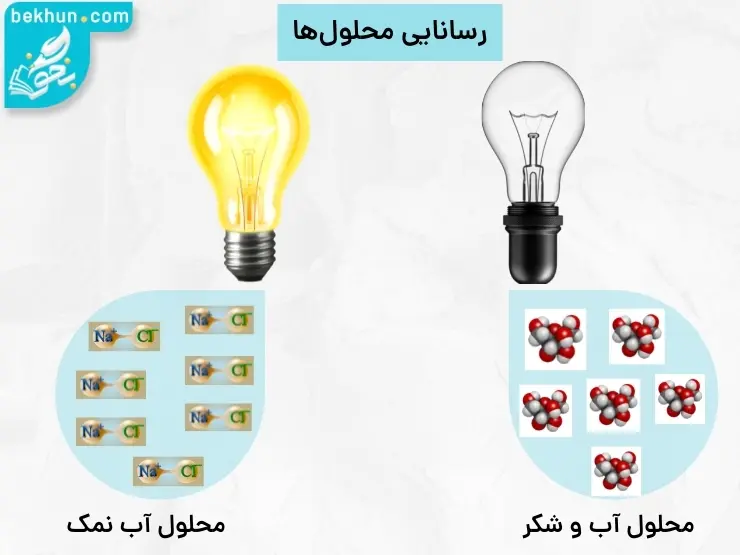
محلول آبی سدیم کلرید دارای یونهای +NA و -Cl است که آزادانه و نا منظم در سر تا سر محلول پراکندهاند و با برقراری مدار الکتریکی جریان برق در مدار شکل میگیرد زیرا یونهای منفی جذب قطب مثبت و یونهای مثبت جذب قطب منفی خواهند شد و جابه جایی یونها نشانگر حرکت الکترونها در محلول است و این حرکتها منجر بهرسانایی محلول سدیم کلرید میشوند.
به سدیم کلرید الکترولیت و به محلول سدیم کلرید محلول الکترولیت گفته میشود.
همهی محلولهای یونیرسانایی یکسانی ندارند.
دانشمندان برای بیان میزان یونش اسیدها از کمیتی به نام درجه یونش استفاده میکنند و درجه یونش محلولهای اسیدی را از طریق فرمول بدست میاورند.

رسانایی محلول 1/0 مولار هیدروکلریک اسید ازرسانایی 1/0 مولار محلول هیدروفلویوریک اسید در شرایط یکسان بیشتر است و غلظت انیون و کاتیون در محلول هیدروکلریک اسید بیشتر است و دانشمندان با توجه به توصیفات آرنیوس از اسیدها هیدروکلریک اسید را یک اسید قوی و هیدروفلوریک اسید را یک اسید ضعیف نامگذاری میکنند.
به اسیدی که هر مولکول ان در آب میتواند یک یون هیدرونیوم تولید کند اسید تک پروتون دار میگویند.
اسیدها را میتوان بر اساس یونشی که در آب دارند به دو دسته قوی و ضعیف دستهبندی کرد و اسیدهایی را قوی در نظر گرفت که یونشی کامل در آب دارند و اسیدهایی را که به میزان جزء یونیده میشوند را ضعیف در نظر گرفت.
اسیدهای موجود در سیب انگور ریواس و مرکبات مانند پرتقال و لیمو و انواع سرکهها جزو دسته اسیدهای ضعیف هستند که در ترکیبات این مواد محلولی از یونهای آب پوشیده به همراه تعداد زیادی از مولکولها یونیده نشده حضور دارند.
برای تسلط بهتر شما بر مبحث درجه یونش پیشنهاد میکنم نمونه سوالات زیادی را برسی کنید تا به تسلط کافی برسید و برای دسترسی به نمونه سوالات میتوانید از بخش نمونه سوالات شیمی دوازدهم اقدام کنید.
آموزش مبحث ثابت تعادل و قدرت اسیدی شیمی دوازدهم
حضور هم زمان واکنشدهندهها و فراوردهها در مخلوط واکنش را میتوان نشانهای از برگشتپذیر بودن واکنشها دانست. واکنشهایی که در آنها همه واکنشدهندهها به فراوردهها تبدیل نمیشوند، بلکه در شرایط معین مقدار آنها در سامانه ثابت خواهد ماند.گویی این واکنشها تا حدی پیش میروند و پس از آن، مقدار مواد شرکتکننده دیگر تغییر نخواهد کرد.
واکنشهای برگشتپذیر، آنهایی هستند که میتوانند در هر دو جهت انجام شوند. این نوع واکنشها در شرایط مناسب هم زمان در هر دو جهت رفت و برگشت انجام میشوند تااینکه سرانجام لحظهای فرا میرسد که غلظت واکنشدهندهها و فراوردهها ثابت میماند.
این ویژگی تنها هنگامی رخ میدهد که سرعت واکنش رفت با برگشت برابر شود زیرا در این شرایط، هر مقداری از فراوردهها که در واحد زمان تولید میشود، هم زمان به همان مقدار ازآنها مصرف میشود. برای واکنشدهندهها نیز چنین است. در شیمی به چنین سامانههایی، سامانه تعادلی میگویند.
واکنشهای رفت و برگشت در سامانههای تعادلی به طور پیوسته و با سرعت برآبر انجام میشوند و به همین دلیل مقدار مواد شرکتکننده در سامانه ثابت میماند.
محلول اسیدهای ضعیف در آب نمونهای از سامانهی تعادلی است. در این محلولها به دلیل یونش کم اسیدهای ضعیف با اندک مولکولهای یونیده نشده تعادل برقرار میشود.
برای این سامانه نیز در دمای ثابت همانند دیگر سامانههای تعادلی، واکنشهای رفت و برگشت پیوسته در حال انجام هستند به طوری که در هر گسترۀ زمانی معین، شمار مولکولهای به یکدیگر H + و F – که از پیوستن یونهای HF که یونیده میشوند با شمار مولکولهای HF پدید میآیند، برابر است. در محلول هیدروفلرویک اسید تعادل زیر برقراراست.
HF(aq)↔H+ (aq) F– (aq)
در دمای ثابت واکنشهای رفت و برگشت پیوسته در حال انجام است و سرعت تولید هرگونه با سرعت مصرف ان برابر است و منجر به ثابت شدن غلظت تعادلی همهی گونهها در سامانه است.
سامانه تعادلی را از دیدگاه کمی نیز میتوان برسی کرد و سامانهها را با کمیتی به نام ثابت تعادل توصیف میکنند و غلظت تعادلی گونههای شرکتکننده در واکنش مطرح خواهد بود و مقدار این کمیت در دمای ثابت برای هر تعادل ثابت است.
عبارت ثابت تعادل را با حرفK نشان میدهند
واکنش تعادلی زیر را در نظر بگیرید:
aA+bB⇌cC+dD
اگر غلظت مولار هر یک از اجزای واکنشدهنده و فرآورده را داشته باشیم، ثابت تعادل از رابطه زیر بدست میآید:
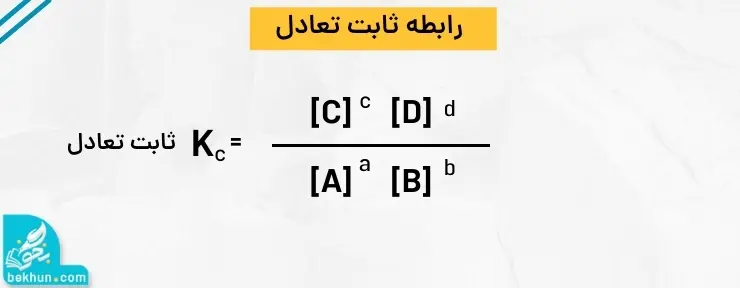
K برای یک واکنش تعادلی در دمای معین مقداری ثابت است.
ثابت تعادل برای اسیدها نیز تحت عنوان ثابت یونش اسید تعریف میشود.
کمیتی که نشان داده میشود. ثابت یونش یک اسید، نسبت حاصل ضرب غلظت تعادلی یونهای Ka با موجود در محلول را به غلظت تعادلی آن اسید نشان میدهد.
به بیانی دیگر ثابت یونش، بیانی از میزان پیشرفت فرایند یونش تا رسیدن به تعادل است، به طوری که هر چه ثابت یونش اسیدی در دمای معین بزرگتر باشد، آن اسید بیشتر یونیده شده و غلظت یونهای موجود در محلول آن بیشتر است. در واقع در دمای معین هر چه ثابت یونش اسیدی بزرگتر باشد، آن اسید قویتر است.
آموزش PH مقیاسی برای تعیین میزان اسیدی بودن
با کاغذ PH و تغییر رنگ آن در اثر برخورد با اسید و بازها آشنا شدیم. تغیر رنگ کاغذ PH معیاری برای تشخیص اسید یا بازی بودن محلولها است و تا حدودی میزان اسیدی و یا باز بودن یک محلول را نیز تعیین میکند.
برای بیان غلظتهای کم و بسیار کم یون هیدرونیوم میتوان از کمیت PHاستفاده کرد زیرا اعدادی به مراتب سادهتر و قابل فهمتر ارائه میدهد. این کمیت برای محلولهای آبی در دمای اتاق با اعدادی در گستره 0 تا 14 بیان میشود.
پیوند با ریاضی شیمی دوازدهم فصل اول
لگاریتم یکی از مسائل کاربردی در فیزیک و ریاضی و شیمی است که داوطلبان همواره با یادگیری آن مشکل دارند.
لگاریتم یک عدد در یک پایه، برآبر با توانی از پایه است که آن عدد را حاصل میشود. برای نمونه لگاریتم ۱۰۰۰ در پایهٔ ۱۰، برآبر با ۳ است. چون ۱۰ × ۱۰ × ۱۰ = ۱۰۰۰ یا به بیان کلیتر اگر x = by باشد آنگاه لگاریتم x در پایهٔ b برآبر با y خواهد بود.

آب خالص دارایرسانایی کمی است و بیانگر وجود یونهای هیدرونیوم و هیدروکسید است و در یک نمونه از آب خالص تعداد بسیار کمی از مولکولهای H2O به یونهای +H و OH- یونیده میشوند.
هر اندازه غلظت یکی از یونهای هیدرونیوم یا هیدروکسید در آب خالص بیشتر شود به همان نسبت از دیگری کاسته خواهد شد، تا حاصل ضرب غلظت این یونها در دمای اتاق برآبر ۱۰ به توان ۱۴- شود.
آموزش مبحث بازها محلولهایی با محدوده PH بین 7 تا 14
سود سوز اور NAOH و پتاس سوزاور KOH جزو دستهی بازهای قوی هستند و مواد خورنده حساب میشوند و PH آنها در دمای اتاق بین ۷ تا ۱۴ خواهد بود و هر میزان یون هیدروکسید در محلول آنها بیشتر باشد PH بزرگتر و به ۱۴ نزدیکتر است.
لوله بازکن و شیشیه پاکن نمونه بازهای پر کاربرد زندگی هستند.
آمونیاک از جمله بازهای ضعیف است و در محلول امونیاک تعداد کمی یونهای آب پوشیده یافت میشود.
آموزش نحوه عملکرد شویندههای خورنده فصل اول شیمی دوازدهم
یکی از رفتاریهای پر کاربرد اسید و بازها تماس و واکنش شیمیایی با یک دیگر است به طور مثال واکنش بین محلول هیدروکلریک اسید با سدیم هیدروکسید منجر به تبدیل شدن یونهای هیدروکسید در واکنش با یونهای هیدرونیوم به مولکول آب است و نشاندهندهی واکنش خنثی شدن اسید و بازها است.
واکنش خنثی شدن اسید و بازها مبنایی برای پاککنندهها و شویندهها است.
فرض کنید مسیری لولهای با اسیدهای چرب مسدود شده است و برای باز کردن مسیر لوله از محلول سدیم هیدروکسید غلیظ استفاده میکنیم.
موادی که سبب گرفتگی این لولهها و مجاری میشوند، خاصیت بازی دارند، به طوری که روی دیواره لولهها و مجاری به شکل رسوب به جای ماندهاند. در این حالت، لوله بازکن در واکنش با این رسوبها، فراوردههای محلول در آب یا گازی تولید میکند و از این راه سبب جرمگیری در آنها میشوند.
تدریس پیوند با زندگی صفحه ۳۱ شیمی دوازدهم
ریفلاکس معده یا برگشت اسید معده به مری یکی از مشکلات اسید قوی معده است و با افزایش وعدههای غذایی و کم کردن حجم غذا در هر وعده به نوعی میتوان پیشگیری کرد.
اما برخی اوقات برای درمان عوارض ناشی از برگشت اسید معده از داورها استفاه میکنند که ضداسیدها دسته از داروها هستند که پزشکان تجویز میکنند و شامل منیزیم هیدروکسید است که اسید معده را خنثی میکند.
واکنش خنثیسازی اسید معده 2HCl (aq) + Mg (OH)2(aq) → MgCl2(aq) + 2H2O (L)
خب دوستان و همراهان گرامی به پایان مقاله آموزش فصل اول شیمی دوازدهم مولکولها در خدمت تندرستی رسیدیم و شما می توانید از دیگر بخش های آموزش شیمی دوازدهم نیز بهرهمند شوید و مقالات آموزشی دیگر را نیز مطالعه کنید.
سوالات متداول
- فرمول های حل مسئله یونش و ثابت تعادل نیز آموزش داده شده است؟
بله به صورت کامل اموزش داده شده است. - اموزش برای امتحانات و نمره بیست کاربردی است؟
بله آموزش به صورت اصولی و مفهومی میباشد. - مبحث اسید و بازها اموزش داده شده است؟
بله صفر تا صد اسید و بازها برسی شده است. - حاوی تصاویر آموزشی می باشد؟
بله می توانید از تصاویر آموزشی مفهومی ذکر شده بهره ببرید.